|
بوم شناسی بوم شناسی علم مطالعه روابط موجودات زنده با همدیگر و همچنین محیط آنهاست
| ||
|
|
در اولین مرحله ی هر دو نوع همزیستی یعنی میکوریزا و باکتری های ریزوبیالی، میکروب ها با توی برگشتگی غشاء پلاسمایی (اینواجیناسیون) احاطه می شود و در مورد میکوریزای آربوسکولار و برخی گونه های لگوم که باکتری ها در نوار آلودگی تثبیت ازت را انجام می دهند (Naisbitt et al. 1992)، غشاء پری باکتروئید و غشاء پری آربوسکولار با غشاء پلاسمایی به حالت پیوسته باقی می ماند. سیمبیوزوم های بیشتر لگوم ها هویت مجزایی مانند اندامک های سیتوپلاسم بوده و با واکوئل های کوچک و یا وزیکول ها قابل قیاس هستند تا غشاء پلاسمایی. سیمبیوزوم ها چندین ویژگی مشترک با مجموعه پیش واکوئلی دارند. مثلا با واکوئل های لیتیک به منظور تجزیه محتویات آن ها ترکیب می شوند (Mellor 1989). بررسی نشانه های غشایی نشان داد که غشاء سیمبیوزوم یک ماهیت حدواسط دارد. محدود شدن سینتاکسین MtSYP132 در گیاه مدیکاگو ترانوکلاتا به غشاء سیمبیوزوم حاکی از ماهیت غشاء پلاسمایی بودن است که نشان می دهد باکتری ها در یک بخش آپوپلاستی درون سلولی ساکن هستند (Catalano et al. 2004, Catalano et al. 2007, Limpens et al. 2009). سپس، همچنین غشاء سیمبیوزوم دارای Rab7 است که نشانه ماهیت آندوزومال/ واکوئل اولیه است. این نشان می دهد که غشاء سیمبیوزوم یک دوره از ماهیت بی اساس را بین غشاء پلاسمایی و ماهیت واکوئلی متحمل می شود. در ابتدای پیری، ظهور علائم SNARE یعنی SYP22 و VTI11 دلالت بر داشتن ماهیت واکوئل لیتیک است که باکتروئیدها در آن هضم می شوند (Limpens et al. 2009). می توان گفت که سیمبیوزوم های فعال در وضعیتی با ماهیت پیش واکوئلی و عملکردی مانند ماهیت غشاء پلاسمایی باقی می مانند. با توجه به صفات متعدد ویژه همزیستی غشاء سیمبیوزوم و غشاء پری آربوسکولار مثل ناقلان عناصر غذایی ویژه همزیستی، یک ماهیت سوم و جدیدی داشته باشند که تا اندازه ای با ماهیت غشاء پلاسمایی و تونوپلاست همپوشانی دارد. بعلاوه، غشاء پری آربوسکولار به زیر واحدهایی مانند تنه و انشعابات ظریف آربوسکول که با پروتئین های نشانه ی مختلفی شناخته می شوند، تقسیم می شود (Pumplin and Harrison 2009). موضوعات مرتبط: اکولوژی، فیزیولوژِی گیاهی، ، برچسبها: [ شنبه 22 تير 1392برچسب:ماهیت غشاء سیمبیوزوم و پری آربوسکولار چیست؟, ] [ 15:0 ] [ حمیدرضا قاسمی ]
گیاهانی که در همزیستی شرکت می کنند، در کنار NFRs و MFRs خود، گیرنده های قوی برای اجزاء دیواره سلولی میکروب ها مانند اولیگومرهای کیتین و پپتیدوگلیکان که می توانند پاسخ های دفاعی را آغاز کنند، دارند (Shimizu et al. 2010, Willmann et al. 2011). چون قارچ های میکوریزا دارای کیتین است، انتظار می رود که پاسخ های دفاعی مسدود کننده ی همزیستی آغاز شود. برخی علائم دفاعی یک القاء موقتی کوچک در مراحل اولیه میکوریزا آربوسکولار (García‐Garrido and Ocampo 2002) نشان می دهد که بیانگر آن است الگوها یا طرح های مولکول های عمومی میکروب (MAMPs) در همزیستی میکوریزای آربوسکولار درک شده و یک پاسخ دفاعی موقت شکل می گیرد که بعدا متوقف می شود. این توقف ممکن است از پیام رسانی های پایین دست NFRs و MFRs یا از دستکاری های قارچ میکوریزای آربوسکولار ناشی شود. برای فرار از پاسخ های دفاعی میزبان، بسیاری از میکروب های مفید و بیماری زا ابزاری را به وجود آورده اند که شناسایی آن ها توسط گیاه میزبان را از طریق مخفی کردن یا جلوگیری از پیشرفت پاسخ های دفاعی مختل می کند (Zamioudis and Pieterse 2012). مثلا قارچ بیماریزای Cladosporium fulvum از روشی استفاده می کند که پس از اتصال کیتین آن به موتیف LysM متصل شونده به کیتین، مانع از شناسایی خود توسط گیاه می شود. به این ترتیب که مقدار زیادی پروتئین LysM دار (Ecp6) ترشح می کند که به کیتین محلول متصل می شود. بنابراین، از شناسایی کیتین توسط گیرنده های گیاهی جلوگیری می کند (Bolton et al. 2008, de Jonge et al. 2010). از این رو، Ecp6 یک پروتئین اثرگذار است که از آشکار و شناسایی شدن عامل بیماریزا توسط میزبان ممانعت می کند و به قدرت بیماریزایی آن کمک می کند. اخیرا یک اثرگذار برای قارچ میکوریزای آربوسکولار یافت شده که توسط میزبان جذب شده و از راه تعدیل بیان ژن های هسته ای مرتبط با دفاع عمل می کند (Kloppholz et al. 2011). باکتری های بیماریزا نیز اثرگذارهایی برای تداخل در عملکرد گیرنده LysM تولید و به موجب آن از شناخته شدن جلوگیری می کند. اثرگذارهای باکتریایی در بیشتر موارد به طور مستقیم با سه نوع سیستم ترشحی (که در ریزوبیوم ها نیز دیده می شود) به سیتوپلاسم سلول میزبان تحویل داده می شود. ریزوبیا (Kambara et al. 2009) نیز حاوی همولوگ های برای اثرگذارهای بیماریزاست که در غیرفعال شدن و طیف میزبان در همزیستی ریزوبیالی موثر است (Lewis et al. 2011). موضوعات مرتبط: اکولوژی، فیزیولوژِی گیاهی، ، برچسبها: [ شنبه 22 تير 1392برچسب:چرا قارچ های میکوریزا به یک پاسخ دفاعی از سوی میزبان منجر نمی شوند؟, ] [ 14:57 ] [ حمیدرضا قاسمی ]
بر اساس ثبت فسیل ها و وقوع گسترده ی میکوریزای آربوسکولار بین بیشتر گیاهان آوندی، احتمالا منشاء میکوریزای آربوسکولار به قبل از انشعاب گیاهان خشکی زی بر می گردد (Kistner and Parniske 2002). ممکن است که میکوریزای آربوسکولار پیش شرطی برای تکثیر موفقیت آمیز در خشکی باشد (Brundrett 2002)، گرچه ممکن است اولین شکل همزیستی میکوریزای آربوسکولار نباشد (Bidartondo et al. 2011). مشخص شده که ژن های مسیر SYM عملا بین گونه های تک و دو لپه ای حفظ شده باشد (Chen Caiyan et al. 2007, Gutjahr Caroline et al. 2008, Gutjahr Caroline et al. 2012a) و در گیاهان ابتدایی مانند جگرواش ها، شاخ گوزنی ها، خزه ها و لیکوفیت ها که منشاء کهن دارند، دیده می شود (Wang Dong et al. 2010). نهاندانگانی که میکوریزا تشکیل نمی دهند مانند علف گوش موشی بیشتر ژن های مسیر SYM را ازدست داده اند در حالی که خزه Physcomitrella patens همولوگ های این ژن ها علی رغم ناتوانی اش در درون همزیستی، حفظ کرده اند (Ligrone et al. 2012, Wang Dong et al. 2010). از آنجایی که تعداد ژن های یکسان و مشترکی در هردو نوع همزیستی لازم است و اینکه همزیستی ریزوبیالی فقط در تعداد کمی از نهاندانگان دیده می شود، می توان گفت همزیستی ریزوبیالی کمتر از 100 میلیون سال قبل در جد نهاندانه که قبلا مستعد برای همزیستی میکوریزای آربوسکولار بوده، تکامل یافته است (Kistner and Parniske 2002). با توجه به انواع مختلف گره زایی، نکته جالب این است که ژن های مسیر SYM در گونه هایی (A. glutinosa و C. glauca) که همزیستی آکتینوریزال تشکیل می دهد (Hocher et al. 2011a, Hocher et al. 2011b)، از این ایده حمایت می کند که ایده همزیستی آکتینوریزال به مستقل از همزیستی ریزوبیالی لگوم ها تکامل یافته است اما از یک جد مشترک مستعد همزیستی باکتریایی (Pawlowski and Demchenko 2012, Soltis et al. 1995) شاید با تغییر حوزه LRR گیرنده کیناز مانند (SYMRK) (Markmann et al. 2008). شباهت های بین NFs و MFs و گیرنده های آن ها (Maillet et al. 2011) نشان از روند تکاملی مشابه در هر دو نوع همزیستی است (den Camp et al. 2011). بعلاوه، شباهت زیاد NFRs و CERK1 نشان می دهد که شناسایی همزیست ها و پاتوژن ها از سازوکاری مشابه در جد مشترک ناشی می شود (Zhang Xue-Cheng et al. 2009). چون کیتین، پپتیدوگلیکان و NF/MF یک ساختار پایه مشترک، محور ان استیل گلوکز آمین دارند و چون آن ها همگی با گیرنده های LysM درک می شوند، قابل درک است که شناسایی پیام های همزیستی از یک سازوکار شناسایی برای پیام میکروبی ناشناخته مثل کیتین تکامل یافته است. تنوع پیام رسانی همزیستی ممکن است توسط تکامل توام NFRs با NFs طی تکامل همزیستی ریزوبیالی شکل گرفته باشد (Martinez-Romero 2009, Nakagawa et al. 2011). موضوعات مرتبط: اکولوژی، فیزیولوژِی گیاهی، ، برچسبها: [ شنبه 22 تير 1392برچسب:تکامل پیام رسانی همزیستی, ] [ 14:55 ] [ حمیدرضا قاسمی ]
در طبیعت، اکثر گیاهان در ارتباط با قارچ و یا باکتری های همزیست زندگی می کنند. گسترده ترین نوع همزیستی در همه گونه های گیاهان خشکی زی، میکوریزا آربوسکولار است. ثبت فسیل و تحلیل تبارشناختی نشان می دهد که اولین نشانه مربوط به میکوریزا آربوسکولار به قبل از دوره ی دوونین یعنی حدود 450 میلیون سال پیش بر می گردد (Heckman et al. 2001, Kistner and Parniske 2002, Redecker et al. 2000). میکوریزا آربوسکولار بین قارچ های گلومرومیکوتا و اکثر گیاهان خشکی زی در هر آشیان زیست محیطی رخ می دهد (Wang B. and Qiu 2006) و به نظر می رسد که برای بقاء گیاه در محیط های سخت نظیر بیابان ها و چشمه های گرم ضروریست (Al-Yahya'ei et al. 2011, Bunn et al. 2009). همزیستی با باکاری های ریزوبیال که پس از میکوریزا آربوسکولار تکامل یافته است، بیشتر در گیاهان خانواده حبوبات رخ داده در حالی که میکوریزا آربوسکولار با ریشه اکثر گیاهان می تواند به وجود آید (Kistner and Parniske 2002). این دو شکل از همزیستی، با مجموعه ژن های مشترکی تنظیم می شوند که مسیر SYM عمومی را تعیین می کنند. این ژن ها یک گیرنده کیناز که در غشاء پلاسمایی قرار دارد، اجزاء هدایت پیام به هسته و یک پروتئین کیناز وابسته به کلسیم و کالمودولین را به رمز در می آورند (Oldroyd G. E. et al. 2011, Parniske M. 2008b, Singh and Parniske 2012). به مجرد آشکار شده هایفوپودیای قارچ میکوریزا آربوسکولار سلول های اپیدرمی یک ساختمان آلودگی که برای آلوده شدن سلول های اپیدرمی ضروریست، تولید می کنند (Genre Andrea et al. 2005, Genre Andrea et al. 2008). در مراحل بعدی میکوریزا آربوسکولار، ساختارهای هایفی بسیار منشعب (آربوسکول ها) توسط قارچ های میکوریزا آربوسکولار برای افزایش سطح تبادل عناصر غذایی به وجود می آید. در همزیستی ریزوبیالی، سلول های تارکشنده یک حلقه تشکیل می دهند که باکتری ها در آن به دام افتاده و از راه طناب آلودگی به سمت پوست ریشه ادامه می یابد(Fournier et al. 2008). سلول های پوستی قبل از اینکه با ریزوبیوم ها تماس برقرار کنند، برای آلودگی کمک پیش نوار آلودگی آماده می شوند (van Brussel et al. 1992). سرانجام، در گره های بالغ، باکتری ها در درون سیتوپلاسم میزبان به باکتروئید تمایز می یابند (Oldroyd G. E. et al. 2011, van Brussel et al. 1992). آربوسکول ها و باکتروئیدها توسط غشاهایی احاطه می شوند که از میزبان مشتق شده و یک فصل مشترک تخصصی همزیستی برای تبادل مواد غذایی به وجود می آورد (Cox and Sanders 1974, Limpens et al. 2005, Parniske Martin 2008a). در نتیجه این تماس، هنگام تشکیل تشکیل آربوسکول، سطح غشاهای سلول های میزبان (غشاء پلاسمایی و غشاهای اطراف درون همزیست) چند برابر شده (Cox and Sanders 1974) و به حدود 20 برابر غشاهای تولید شده در گره های حاصل از همزیستی ریزوبیوم ها، افزایش می یابد (Verma et al. 1978). به طور مشابه، سیستم غشاء درونی یک توسعه عمومی را متحمل می شوند زیرا مقدار اندامک هایی مانند پلاستیدها، شبکه آندوپلاسمی و میتوکندری ها افزایش می یابد (شکل 1و2) (Fournier et al. 2008, Genre Andrea et al. 2005, Genre Andrea et al. 2008, Lohse et al. 2005). این سازش ها طی انتقال یک سلول پوستی به یک ماشین همزیستی فعال نیازمند تولید مقدار زیادی مواد غشایی جدید در میزبان و پروتئین های غشایی اختصاصی برای برقراری ارتباط همزیستی و تبادل مواد غذایی است. مادامیکه اجزاء درگیر در شناسایی و هدایت پیام به طور مداوم در حال بیان شدن هستند، ماشین مورد نیاز برای عملکرد درون همزیست ها در نتیجه ی برنامه ریزی مجدد رونویسی سلول میزبان همزیستی، القاء می شود. بسیاری از این ژن ها که ناقلان عناصر غذایی گوناگون را به رمز در می آورند، صرفا در سلول های میزبان همزیستی بیان می شوند و بنابراین نقش ویژه ای در تخصصی بودن همزیستی ایفا می کنند. در مورد میکوریزای آربوسکولار، گیاه عناصر غذایی مانند فسفات، نیتروژن، سولفور، روی و مس که توسط غشاء پری آربوسکولار در سلول های حاوی آربوسکول گرفته می شود، را دریافت نموده (Allen and Shachar-Hill 2009, Clark and Zeto 2000, Karandashov and Bucher 2005, Smith Sally E et al. 2011) در حالی که در همزیستی ریزوبیالی، گیاه صرفا از ریزوبیوم نیتروژن دریافت می کند (Prell and Poole 2006). در مقابل گیاه برای همزیست خود قند فراهم می کند (Prell and Poole 2006, Smith Sally E et al. 2011). همسو با نقش محوری غشاءها در همزیستی، بخش بزرگی از پروتئین های مرتبط با همزیستی در غشاها قرار دارد. اینجا ما نقش های متعدد سیستم های غشایی در درون همزیستی را مورد بحث قرار داده و پیشرفت های جدید در تحلیل پروتئین های غشایی مرتبط با همزیستی و نقش آن ها در پیام رسانی، تطابق درون سلولی و انتقال عناصر غذایی را مرور می کنیم. موضوعات مرتبط: اکولوژی، فیزیولوژِی گیاهی، ، برچسبها: [ شنبه 22 تير 1392برچسب:مقدمه ای بر همزیستی, ] [ 14:52 ] [ حمیدرضا قاسمی ]
آنزیم نیتروژناز علاوه بر احیای نیتروژن قادر به احیای پیش مادههای دیگر با ویژگی معمول، مولکولهای کوچک و با پیوندهای چندگانه است. از جمله سوبستراهای این انزیم عبارتاند از: استیلن و دیگر الکین ها مانند پروپین و 1ـ بوتین ، الکن ها مانند آلن، 3و3ـ دی فلوروسیلکوپروپن، اتیلن و سیلکو پروپن، ترکیبات حاوی کربن و نیتروژن با پیوند سه گانه از جمله سیانید هیدروژن، نیتریل ها و ایزونیتریل ها و... . نیتروژناز همچنین می تواند پیوندهای C=O و C=S را در کربونیل سولفید (COS)،کربن دی سولفید (CS2)، تیوسیانات و سیانیت احیا کند. جنبه مهم فهم سازوکار نیتروژناز این است که چطور و کجا سوبستراها باند میشوند؟ با استفاده از جانشینی آمینو اسیدها در کوفاکتور Fe Mo اطلاعات قابلتوجهی به دست آمده است. با این جانشینی ها ثابت شد که یک ارتباط معکوس بین اندازه زنجیره جانبی در موقعیت آلفا والین شماره 70 (α-Val70) و اندازه سوبسترا وجود دارد. به طوری که با کاهش اندازه زنجیره جانبی اندازه سوبسترا افزایش و با افزایش آن سایز سوبستراها کاهش مییابد. جایگاه احیا سوبسترا در صفحه 4Fe4S ویژه در کوفاکتورFeMo قرار دارد که α-Val70 سایز سوبستراها را برای دستیابی به جایگاه فعال کنترل میکند. Fe6 به عنوان یک جایگاه پیوندی ویژه برای برهمکنش سوبسترا در کوفاکتور است. الکین ها و نیتروژن نیز به احتمال بسیار زیاد در یک جایگاه احیا میشود. به طور خلاصه با در نظر گرفتن Co، استلین، آزید، N2O و N2 ، دو جایگاه پیوندی سوبسترا و مهارکننده وجود دارد که درون پروتئین Fe Mo قرار گرفته است. جایگاه اول که قادر به پیوند با استلین یا Co است اما قادر به پیوند با N2، آزید یا N2O نیست. جایگاه دوم قادر به پیوند با Co ، استلین، آزید، N2O و سوبستراهای فیزیولوژیکی N2 است. همچنین مشخص شد که سایت 1 و 2 درون یک صفحه 4Fe4S از کوفاکتور Fe Mo قرارگرفته که توسط α-Val70 , α-Arg69 و α-His195پیوند شده است. یکی از مهمترین خصوصیات سازوکار احیای N2 توسط نیتروژناز این است که زمانی که N2 به آن باند میشود بدون هیچ حد واسطی در نیتروژناز وابسته به مولیبدن به 2NH3 تبدیل میشود. در مدل پیشنهادی، فعالسازی N2 منجر به تشکیل سریع و فوری حد واسط دیازن پیوندی با فلز میشود و هیدروژناسیون بعدی تشکیل هیدرودیازن پیوندی با فلز و نهایتاً با آزادسازی 2آمونیاک است. نیتروژناز باید انرژی این حد واسط ها را با پایداری آنها کاهش دهد. که اکثراً از طریق پیوند با کلاستر فلزی و احتمالاً از طریق واکنش با زنجیرههای جانبی آمینو اسیدی این کار را انجام میدهد. احیای پروتون: در فقدان N2 و سایر سوبستراها تمام الکترونهایی که نیتروژناز طی جریان الکترونی عبور میکند برای احیا پروتون به کار می رود. زمانی که N2وجود داشته باشد کمتر از 25درصد از جریان الکترونی به سمت احیا پروتون می رود و 75درصد در جهت احیا N2به کار می رود. مشخصشده که تولید H2 با احیا N2 رقابت میکند. H2 معمولاً هر جا یک هیدرید در محل آهن تشکیل شود تولید میشود و این زمانی است که پروتونهای اضافی در عدم N2 پیوندی به کوفاکتور انتقال پیدا میکند اگر N2 به کوفاکتور متصل شود پروتونها N2 را احیا میکنند. مهارکنندگان آنزیم نیتروژناز: CO یک مهارکننده غیررقابتی قوی برای تمام سوبستراها بجز پروتون است . در حضور CO انتقال الکترون در طول سیستم مهار نمیشود. اما تمام الکترونها به سمت تولید H2 می روند. مهارکننده دیگر نیتروژناز NO است که پروتئین آهن دار و احتمالاً پروتئین MOFe را به صورت غیر برگشتپذیری غیرفعال میکند. نیتریت نیز پروتئین آهن دار را به طور غیر برگشتپذیری غیرفعال میکند. بین سوبستراها نیز اثرات متقابلی وجود دارد برای مثال، H2 و N2O مهارکنندگان رقابتی N2 هستند. CH3NC ,N3-, CN- به طور دو جانبه رقابتی هستند اما با N2 غیررقابتی هستند. C2H2 غیررقابتی با N2 و N3- است و احیا CN- را افزایش میدهد و نیز میتواند آزادسازی H2 را به طور کامل متوقف کند . N2 به طور رقابتی احیا C2H2 را مهار میکند درحالیکه C2H2 با N2 غیررقابتی است. این مدل رفتار مهاری غیر دو جانبه بین N2 و C2H2 ایجاب میکند که مخزن الکترون در MOFe باید دارای 6 الکترون باشد تا N2 را احیا کند. اما تنها 2 الکترون برای احیا C2H2 کافی است. N2 و C2H2 هر کدام سایت پیوندی خود را دارند و مهار متقابل از اینجا نشأت میگیرد که آنها مخزن الکترونی را به دام میاندازند. درحالیکه غلظت بالای C2H2 این مخزن را کاهش میدهد بنابراین این مخزن هیچگاه نمیتواند محتوای بیشتر از 2 الکترون باشد که بتواند N2 را احیا کند. غلظت بالای N2 هرگز دسترسی C2H2را به مخزن الکترونی ممانعت نمیکند. بنابراین C2H2 یک مهارکننده غیررقابتی در مقابل N2 است. خانم قاسمی - دکتری اصفهان موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ چهار شنبه 8 خرداد 1392برچسب:نیتروژناز و پیش مادههای آن, ] [ 13:29 ] [ حمیدرضا قاسمی ]
بعد از تشکیل گرهک میزان و اندازه آن توسط گیاه میزبان میبایستی کنترل شود. برای جلوگیری از هد رفت انرژی و تنظیم تعداد گرهک ها یکسری سیستم های بازخوردی مانند سیستم خودکار گرهک([1]AON) و تنظیم بازدارنده هورمونی محلی[2](مکانی) وجود دارد. سازوکار مولکولی مسیر AON بعد از شناسایی موتانت های بيش گره زا به صورت فعال صورت گرفت. اثر متقابل موتانت هاي بيش گره زا و گياهان طبيعي نشان داد كه فنوتيپ بيش گره زا توسط ژنوتيپ ساقه شناسايي میشود. تحقيقات نشان میدهد كه سیستم خودکار گرهک (AON) از طريق انتقال علامت Q عمل مینماید. به اینگونه كه توسط يك گیرنده كه عمل كينازي در ريشه دارد تلقيح را درك يا به عبارتي تقسيم در ناحيه گرهك را دريافت مینماید و يا ايجاد يك پروتئين در آبکش ريشه اين مسير ادامه مییابد. اين پروتئين را Q مینامند كه از خصوصيات آن تحرك زياد است .اين پروتئين در برگ يا ساقه به وسیله يك پروتئين كيناز ديگري شناسايي مي شود و نهایتاً بر روي تقسيم سلولي در ناحيه گرهك اثر میگذارد. گیرنده های درگير در اين مسير شامل گیرنده های كينازي غني از واحد هاي لوسين میباشند . اين كينازها بسيار شبيه به كينازهاي CLV1 در علف گوش موشی میباشند كه رشد مريستم را كنترل مینمایند. اين كيناز ها شامل يك بخش خارجي غني از لوسين، يك بخش ميان غشايي و يك بخش كينازي در قسمت سیتوزولی میباشند. بنابراين پروتئين Q توسط ناحيه غني از لوسين در منطقه آپوپلاست شناسايي و در ك میشود اين عمل منجر به فعاليت ناحيه كينازي در منطقه سيتوزولي میشود. دو فسفاتاز ديگر به نام KAPP1 و KAPP2 كه در ارتباط با ناحيه كينازي رسپتور میباشند فعالشده و نهایتاً باعث توليد بازدارنده گرهك يا [3]SDI میشوند . اين بازدارنده از طريق دستگاه آوندي به ريشه انتقال مییابد و از تقسيم بیشتر و ايجاد گرهك هاي جديد ممانعت به عمل میآورد. مطالعات اخير نشان میدهد كه اين بازدارنده كوچك است (كمتر از يك كيلودالتون)، مقاوم به گرما، وابسته به نود عامل، نيازمند به فعاليت GmNARK براي سنتز و شبيه به پروتئين و RNA نيست. مطالعات بيانگر دخالت هورمون جاسمونيك اسيد ( شبيه پروستاگلاندين در انسان ) را محتمل میداند. حضور نيترات در محيط پيام مناسبي براي گياه و حفظ انرژي است لذا گياه سعي بر كنترل تعداد گرهك ها مینماید. در اين خصوص نيترات شبيه سازوکار AON عمل مینماید. يعني حضور نيترات در محيط باعث توليد Q و انتقال آن به برگ میشود. در نهايت برگ ها با سنتز SDI از تقسيم بيشتر در گرهك ممانعت به عمل میآورند. البته علاوه بر مسير فوق، مسير ديگري يا ممانعت محلي نيز امکانپذیر است. بر اين اساس نيترات ها Q را در ريشه آزاد مینماید كه توسط AON LRR RLK مشابه برگ دريافت میشود كه ممانعت ايجاد گرهك ها را سبب میشود. كاربرد برازینو استروئیدها است منجر به كاهش گرهك ها در موتانت En6500 در سويا شد. بعلاوه براسينوئيدها انتقال اكسين را آسان مینماید. در علف گوش موشی مشاهده شده است كه برازينوئيدها بيان PIN را افزايش مي دهند. بنابراين انتقال اكسين و به تبع آن تجمع اكسين در تنظيم محلي در گسترش گرهك ها نقش دارد. جاسمونيك اسيد باعث كاهش در تعداد د گرهك ها شد. كاربرد آبسزيك اسيد در ريشه اثر منفي بر تعداد گرهك ها دارد . با اين وجود غلظت بالاي اين هورمون در هر گرهك بيانگر اثر مثبت آن بر رشد و نمو هر گرهك است. اتيلن مانع افزايش تعداد گرهك ها در ريشه است اما نفوذ باكتري به گياه را تسهيل میکند. ساليسيليك اسيد مانع افزايش تعداد گرهك ها است ولی اثر مثبتي بر توليد ايزوفلاونوئيدها دارد. جيبرليك اسيد هم نقش مثبتي در توليد گرهك و افزايش آن دارد. امیر حسین فرقانی - دکتری اصفهان
[1] systemic Auto-Regulation Of Nodulation [2] local hormonal inhibitory regulation [3] Shoot-Derived Inhibitor
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ چهار شنبه 8 خرداد 1392برچسب:تنظيم گرهك, ] [ 13:24 ] [ حمیدرضا قاسمی ]
نیتروژن عنصری الکترونگاتیو است که موجودات زنده آن را در ساختار مولکول های خود مانند پروتیین ها و اسید های نوکلییک به کار می برند. آنزیم نیتروژناز عمل تثبیت نیتروژن را انجام می دهد، این آنزیم نسبت به اکسیژن حساس بوده و به طور برگشت ناپذیری غیرفعال میگردد. از این رو باکتریهای تثبیت کننده غیرهوازی بوده و یا از مکانیسمهایی جهت غیرهوازی کردن بخشهای مسئول در این فرآیند استفاده مینمایند. مکانیسم های حفاظت اکسیژن در ارگانیسم های تثبیت کننده ازت عبارتند از:استفاده از مکانیسم های تنفسی در ازتو باکتر جهت افزایش تنفس و مصرف تمامی اکسیژن موجود، اتصال به پروتیئن های خاص: مانند Shenthna در ازتوباکتر، تولید لعاب (Slime) ، حذف فتوسیستم 2 در جلبک های سبز آبی، تثبیت ازت در شب و فتوسنتز در روز واستفاده از لگ هموگلوبین ها. اولين بار هموگلوبينهاي گياهي در سال 1939 توسط Kubo شناسايي شدند. او با آناليز رنگدانه قرمز گرهكهاي ريشه گياهان توسط آزمايشات طيف جذبي و كريستاله كردن پروتئين و گروه هم اين نشان داد كه رنگدانه قرمز گرهكهاي ريشه سويا يك «هم پروتئين» ميباشد. بخش پروتئینی هموگلوبین ساختار آلفا هلیکس دارد و مولکول هم را احاطه می کند، هموگلوبین فرم پنتاکوردینانت و هگزا کوردینانت وجود دارند. در نوع پنتاکوردینانت 4 تا از 6 کوردینانت آهن را N حلقه پیرول هِم اشغال می کند، هیستیدین پروکسیمال با اتصال محکم به جایگاه 5 متصل و جایگاه 6 توسط لیگاند های خارجی از جمله O2 و یا NOبه طور برگشت پذیر اشغال می گردد، نوع پنتاکوردینانت در نقل و انتقال نقش دارند که هموگلوبین های همزیست و هموگلوبین جانوری از این دسته می باشند، ساختار هگزاکوردینانت مشابه پنتاکوردینانت می باشد با این تفاوت که در جایگاه ششم هیستیدین دیستال با اتصال سست به جایگاه 6 متصل شده، اکسیژن از آهن الکترون گرفته با NO ترکیب شده و تولید NO3- می کند هموگلوبین های غیر همزیست از این گروه می باشند. در گياهان سه نوع هموگلوبين شناسايي شده است:لگ هموگلوبينها (هموگلوبينهاي همزيست) symbiotic Hb، هموگلوبينهاي غير همزيستي non symbiotic Hb هموگلوبین هایTruncated (2/2). تثبیت ازت توسط باکتریوئید در گرهک ریشه انجام می شود، نیرودهی تثبیت ازت توسط تنفس باکتریایی فراهم می شود، مقادیر زیاد اکسیژن اثر بازدارندگی بر نیتروژناز دارد و این مقدار توسط لگ هموگلوبین ها تنظیم می شود ، لگ هموگلوبین ها از لحاظ ساختاری پنتاکوردینانت می باشند، هموگلوبينهاي غير همزيستي به دو دسته nsHb1 میل ترکیبی زیاد با اکسیژن (ضریب تفکیک پایین با اکسیژن) و nsHb2 میل ترکیبی کمتر با اکسیژن تقسیم می شوند. nsHb1 در انتقال اکسیژن نقشی ندارد، بیان آن ها در تنش غرقابی و تیمار نیترات و نیتریت افزایش می یابد. در تنش غرقابی و شرایط هیپوکسی، میزان تنفس کاهش یافته به دنبال آن مقدار ATP کاهش می یابد ، پمپ Ca++-ATPase رو به خارج تخریب و Ca++ سیتوزول افزایش و بیان nsHb1 افزایش می یابد، افزایش بیان nsHb1 در هیپوکسی به دلیل از بین بردن NO تولید شده می باشد. به این ترتیب که اکسیژن از آهن الکترون گرفته و با NO ترکیب و نیترات و مِت هموگلوبین ایجاد می شود، و بعد از مدت کوتاهی دوباره NO و هموگلوبین بازیابی شده و این سیکل سبب تنظیم غلظت درونی NO و جلوگیری از آسیب های سلولی ناشی از آن و همچنین کنترل مسیر های فیزیولوژی وابسته به سیگنالینگ NO از جمله گراویتروپیسم، حرکات روزنه ای، جوانه زنی بذر، واکنش های دفاعی و مرگ برنامه ریزی شده سلول می گردد. از nsHb2اطلاعات کمی در دست است، در آرابیدوپسیس هگزاکوردینانت هستند. Over expression آن در آرابیدوپسیس در شرایط هیپوکسی نقش آن ها را در از بین بردن NO نشان داد. هموگلوبین های Truncated بر خلاف دو دسته قبلی که ساختار 3/3 داشتند، ساختار 2/2 دارند. در آرابیدوپسیس پنتاکوردینانت در هنگام گرفتن اکسیژن و در حالت احیا هگزاکوردینانت هستند. نقش trHb در گیاه سرکوب فرایند های دفاعی علیه همزیستی و جاروب کردن NO می باشد. سیر تکاملی از هگزا کوردینانت به سمت پنتاکوردینانت می باشد. گرد آوری: خانم قلمکاری - دکتری اصفهان
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ پنج شنبه 2 خرداد 1392برچسب:هموگلوبین های گیاهی, ] [ 23:38 ] [ حمیدرضا قاسمی ]
اتانول به دو روش سنتزي و تخميري توليد مي شود که در روش سنتزي از اتيلن سنتز و در روش تخميري از تخمير مواد طبيعي مانند گياهان قندي، نشاسته اي و سلولزي ساخته مي شود: تركيبات قند دار مانند ملاس نيشكر، ميوه و سر درختيها خرما،ملاس چغندر قند، هندوانه به طور مستقيم و توسط ميکروارگانيسم ها به اتانول تبديل مي شوند. تركيبات نشاسته اي از جمله غلات (گندم ـ ذرت)، سيبزميني، برنج، ابتدا هيدروليز شده و به قند تبديل شده و نهايتاً پس از تخمير به اتانول تبديل می شوند تركيبات سلولزي مانند چوب، ضايعات كشاورزي، زبالههاي جامد شهري، كاغذ بازيافتي ابتدا پيش تيمار و سپس هيدروليز شده و به قند تبديل شوند و نهايتاً پس از تخمير به اتانول تبديل می شوند. مزاياي زيست محيطي اتانول: 1. كاهش انتشارCO2 2. كاهش انتشارCO 3. كاهش انتشار ذرات معلق 4 . فقدان اكسيدهاي سولفور5. فقدان تركيبات آروماتيكه6. افزايش عدد اكتان
ذرت يكي از مهمترين محصولات غذايي بوده و مي تواند از دو طريق جهت توليد بيواتانول استفاده گردد: از طريق نشاسته موجود در دا نه ذرت جهت توليد بيواتانول استفاده از باقيمانده هاي سلولوزي و لیگنینی جهت توليد اتانول مراحل تولید بیواتانول از ذرت تمامي خوشه ذرت به آرد آسياب مي شود وسپس با آب مخلوط مي شده تا توليد mash (خمیر) كند،سپس mash پخته شده و با آنزيم هاي تجزيه كننده نشاسته (آلفا آميلاز) تيمار شده و تخمير روي آن صورت مي گيرد و سپس تقطير شده تا اتانول جدا شودمحصولات فرعي اين پروسه شامل باقيمانده هاي تقطير، كه به عنوان يك ماده غذايي مغذي براي دام استفاده مي شود. دي اكسيد كربن تولیدی هم دارای مصارف متعددی می باشد كه تقريبا در اين پروسه هيچ ضايعاتي وجود ندارد. تولید بيواتانول از پسماندهاي سیب زمینی از دو روش کاتالیز آنزیمی و کاتالیز اسیدی حاصل می شود، مراحل کاتالیز آنزیمی مشابه ذرت می باشد، روش اسیدی مقرون به صرفه تر و سرعت تولید اتانول بیشتر است اما مشکل خوردگی ظروف را دارد. در این روش از اسید کلریدریک یا اسید سولفوریک ر ا جهت تجزیه نشاسته استفاده می شود. زیرا نشاسته نمي تواند مستقيماً توسط مخمر استفاده شود و لذا ابتدا بايد به قند ساده مناسب براي تخمير شكسته شود. گردآوری: خانم قلمكاري موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ پنج شنبه 2 خرداد 1392برچسب:تولید بيواتانول از ذرت وسیب زمینی, ] [ 23:36 ] [ حمیدرضا قاسمی ]
برخی از مزایای جاتوفا که استفاده از بذر آن را در تولید بیودیزل ممکن کرده است عبارتند: مقاوم نسبت به خشکی، رشد در آب و هوای بیابانی و هر نوع خاکی، نیازی به آفت کش ها ندارد، بذر آن به بارورکنندگان آلی نیاز ندارد،رشد سریع، تولید حدود 38 درصد چربی از بذر آن.
استخراج روغن از بذر جاتروفا به سه روش انجام می گیرد:
1-مکانیکی (از طریق فشار).-2-شیمیایی (از طریق ترانس استرفیکاسیون)-3-آنزیمی (استفاده از آنزیم لیپاز)
روش شیمیایی: 2مرحله است
1-ترانس استریفیکاسیون:
فرآیندی است که طی آن اسید چرب با الکل در حضور کاتالیزور ترکیب می شوند الکل ممکن است متانول یا اتانول باشد و کاتالیزور معمولا هیدروکسید سدیم یا هیدروکسید پتاسیم است. محصول اصلی ترانس استریفیکاسیون بیودیزل و گلیسیرین به عنوان محصول جانبی است.
2-جداسازی:
پس از مرحله ی اول فاز بیودیزل از فاز گلیسرین جدا می شود و هر دو خالص می شود. عوامل موثر بر استریفیکاسیون عبارتند از:
رطوبت و اسیدهای چرب زمان واکنش، دمای واکنش، نوع کاتالیزور، نسبت مولی الکل به روغن
روش آنزیمی
در این روش هم از لیپازهای خارج سلولی و هم از لیپازهای داخل سلولی استفاده می شود. همچنین بجای آنزیم می توان از سلول کامل استفاده کرد. بدلیل اینکه میزان اسیدهای چرب غیر اشباع در بیودیزل گیاهی بالاست چهار راه برای پردازش این روغن ها استفاده می شود تا استفاده از آنها در موتورهای دیزلی ممکن شود. این روش ها عبارتند از:
1-استفاده مستقیم و مخلوط با ماده ی دیگر
2-پیرولیزیز (تغییر شیمیایی در اثر حرارت)
3- امولوسیون سازی
4- ترانس استریفیکاسیون
مشکلات استفاده از جاتروفا برای تولید بیودیزل عبارتند از:
سمی بودن گیاه،
1- روش ماشینی مناسبی برای برداشت آن وجود ندارد
2- دانه ها برای تولید روغن نیاز به دستگاهی برای له کردن دارد زیرا روغن جاتروفا به سختی از بذر خارج می شود و توسط صافی فشار صاف می شود و زمان برداشت محصول طولانی است
3- ایراد استفاده از این روغن به جای سوخت های فسیلی هزینه زیاد استخراج آن است.
جلیل عباس پور
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ یک شنبه 29 ارديبهشت 1392برچسب:تولید بیودیزل از گیاه جاتروفا, ] [ 15:20 ] [ حمیدرضا قاسمی ]
فلاونوئيدها دسته ای ازمتابولیت های ثانویه پلي آروماتيکی هستند که توسط مسیر فنیل پروپانوئیدی در گیاهان سنتز می شوند و شامل کالکون ها، فلاوون ها، فلاونول ها، آنتوسیانین ها، پروآنتوسیانین ها و آئورن ها می باشند. این ترکیبات در ارتباطات ريزوسفريك گياه ـ ميكروب و گياه ـ گياه ( مشخص ترین آن سيگنال شروع همزيستي ريزوبيوم ـ لگوم است)، سيگنال هايي در ايجاد همزيستي ميكوريزي آربوسكولار و اکتینوریزال ،برهمكنش هاي آللوپاتي، حفاظت در مقابل UV ،تولید مثل جنسی،رنگ دهی گل ها و دفاع نقش دارند. فلاونوئیدها در سه نوع اصلی درون همزیستی شامل: میکوریزای آربوسکولار قارچی، لگوم-ریزوبیوم و فرانکیا نقش دارند. نقش فلاونوئیدها در همزیستی لگوم-ریزوبیوم عبارت است از: جاذب شیمیایی ریزوبیوم ،تنظیم بیان ژن های nod و نمو گرهک. فلاونوئيدها ممكن است در 3 مرحله ي متمايز تشكيل گرهك شامل: القاء كننده ژن nod در ريزوسفر، القاء کننده بيوسنتز فاكتور Nod در طناب آلودگي و تنظيم کننده انتقال اكسين که شروع تقسيم سلولی پريموردياي گرهك را بدنبال دارد نقش داشته باشند. در مورد همزیستی اکتینوریزال سیگنال های فرانکیا ناشناخته است اما این سیگنال سلول های تارکشنده را پیچیده و شاخه دار می کند، وزن مولکولی کمتر از kD 3داشته و نسبت به گرما پایدار است (شبیه به فاکتور Nod ریزوبیوم)، همچنین آب دوست بوده و نسبت به کیتیناز مقاوم است (برخلاف فاکتور Nod ریزوبیوم). فلاونوئیدها در همزیستی فرانکیا در سیگنالینگ و عمل گرهک نقش دارند. فلاونوئیدها اثرات مثبتی بر روی رشد هیف ها، تشکیل اسپورهای ثانویه، جوانه زنی اسپور و توسعه كلنيزاسيون در همزیستی میکوریز آربوسکولار دارند. دسته دیگری از ترکیبات فنولی فنوليك اسيدها هستند که این ترکیبات در پاسخ هاي دفاعي گياهان به حمله ي ميكروبي نقش داشته ومنبع كربن برای ميكرو ارگانيسم ها (منابع كربني جايگزين براي برخي دي آزوتروف ها در شرايط محيطي محدود شده، منبع كربن برای گونهها ي ريزوبيومي)، به عنوان پيش ماده براي توليد ليپيدهاي فنولي بوده و همچنین در دفاع ريزوبيومي و مورفوژنز گرهك نقش دارد. مشخص شده است بین فلاونوئیدها و هورمون اکسین برهمکنش هایی در جهت تشکیل گرهک وجود دارد. خاموش سازی مسیر فلاونوئیدی در یونجه بنفش تلقیح شده با سینوریزوبیوم ملی لوتی توسط واسون وهمکارانش (2006) با استفاده از RNA خاموش کننده برای خاموش سازی سنتز کالکون سنتاز نشان داد که: 1- ریشه هایی که نقص در سنتز فلاونوئیدها داشتند قادر به تشکیل گرهک نبودند.
2- پیچش طبیعی در تار کشنده در این ریشه ها مشاهده شد.
3- این ریشه ها در مقایسه با ریشه های شاهد انتقال اکسین بیشتری را نشان دادند
4- تیمار با فلاونوئیدهای خارجی(نارییجنین و لیکوایریتیجنین) موجب تشکیل گرهک گردید.
نتیجه اینکه فلاونوئیدهای ریشه برای تشکیل گرهک در یونجه بنفش ضروریست و آن ها به عنوان تنظیم کننده های انتقال اکسین عمل می کنند بدین صورت که با ممانعت از انتقال قطبی اکسین سبب تجمع سطحی اکسین و در نتیجه شروع تقسیم سلولی می شوند که تشکیل گرهک را بدنبال دارد. در گرهک نمو یافته اکسین از طریق ناقل LAX منتقل می شود. لوئیس و همکارانش (2011) اثرات اکسین و پیش ساز سنتز اتیلن (ACC) را بر روی ریشه های آرابیدوپسیس نوع وحشی و موتانت های غیر حساس بررسی کردند و نشان دادند که مسیرهای سیگنالینگ اکسین و اتیلن برای افزایش فلاونول ها از طریق تنظیم کنندگان مثبت متابولیسم فلاونوئیدی MYB12 ، TTG1 ، PAP1 تداخل می کند. ولی MYB12 نقش مرکزی را در این تداخل برعهده دارد.علاوه بر این آزمایشات نشان داد که کوئرستین فلاونولی است که انتقال بازی پتال اکسین را تعدیل می کند.
تنظیم کننده: جلیل عباس پور
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ یک شنبه 29 ارديبهشت 1392برچسب:نقش فلاونوئید ها و سایر ترکیبات فنولی در همزیستی, ] [ 15:3 ] [ حمیدرضا قاسمی ]
هورمون ABA در بسیاری از فرآیندهای نموی گیاهان از جمله ممانعت از جوانه زنی، خواب بذر،تنظیم رشد، ریزش میوه و بسته شدن روزنه نقش دارد. ازآنجایی که ABA بعنوان یک پیک داخلی در پاسخ به استرس غیرزیستی در گیاهان بکار می رود، بنابراین هورمون تنش نامیده می شود. گیاهان در شرایط تنش غیرزیستی از طریق تغییرات بیان ژن، مقدار زیادی ABA را در خود جمع می کنند. بنابراین درک پیام و انتقال ABA ضرورت دارد.
بطور کلی گیرنده های ABA شامل سه دسته می شوند:
الف) رسپتورهای کلروپلاست و هسته
ب) رسپتورهای غشاء پلاسمایی
ج) رسپتورهای هسته و سیتوزول
رسپتورهای کلروپلاستی عبارتند از:
1) ABAR
2) CHLH
3) GUN5
رسپتورهای غشاء پلاسمایی:
4) GCR2
5) GTG1/ GTG2
رسپتورهای هسته و سیتوزول:
6) RCAR
7) PYR
8) PYL
علاوه بر رسپتورها 2ژن ناقل ABA در گیاه آرابیدوپسیس شناسایی شده که متعلق به خانواده ناقلین ABC هستند:
1) AtABCG25: خارج کننده ی ABA از سلول است.
2) AtABCG40: وارد کننده ی ABA به سلول است.
تحقیقات اخیر دو نوع پروتئین فسفاتاز تیپ PP2c را شناسایی کرده که تنظیم کنندگان منفی سیگنالینگ ABA هستند.
مترجم: عباسپور - دکتری اصفهان
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ شنبه 28 ارديبهشت 1392برچسب:گیرنده های آبسزیک اسید, ] [ 7:53 ] [ حمیدرضا قاسمی ]
تبدیل کارآمد مواد لیگنوسلولزی (LCMS) به سوخت اتانول به یک اولویت جهانی برای تولید انرژی تجدیدپذیر، سازگار با محیط زیست و با قیمت مناسب برای بخش حمل و نقل، تبدیل شده است. سوخت اتانول می تواند به عنوان بنزین با اکسیژن بالا استفاده شود و اکسیداسیون بهتر هیدروکربن ها را امکان پذیر ساخته و همچنین میزان انتشار گازهای گلخانه ای را به اتمسفر کاهش دهد. سه مرحله کلیدی (پیش تیمار، هیدرولیز و تخمیر) جهت بهبود عملکرد و تولید بیواتانول و همچنین کاهش مقدار سرمایه و هزینه های عملیاتی وجود دارد. مناسب ترین همی سلولزها، گزیلان ها و گلوکومانان ها بوده که گزیلان ها فراوان ترین آن ها هستند که باید به از لیگنین جدا شوند. به همین منظور پیش تیمارهای مختلفی مانند هیدرولیز اسیدی، تیمارهای قلیایی و گرمابی، محلول های یونی و سوپر اسیدها ایجاد شده است. هر یک از روش های مذکور معایب و مزایایی دارند ولی همه ی آن ها در مقیاس آزمایشگاهی صورت گرفته و در مقیاس صنعتی به بوته ی آزمایش قرار نگرفته است. پس، پیش تیمار ایده آل باید به بیشترین بازیافت قند و کمترین مقدار محصول جانبی ختم شود. پس از اعمال پیش تیمار مناسب، باید از میکروارگانیسم های مفید و کارآمدتر نیز استفاده شود تا بیواتانول بیشتر و با کیفیت تری به دست آید. ویژگی های میکرواورگانیسم هایی که در تولید سوخت اتانول نقش دارند عبارتند از: 1- توانایی طبیعی برای تبدیل مواد لیگنوسلولزی به اتانول 2- متابولیسم همی سلولز و اولیگوساکاریدهای حاصل از آن 3- دستورالعمل های مهندسی تکاملی و متابولیک برای بهبود نژاد موجودات مختلفی قادرند با توانایی ها و مزایا یا معایب متفاوتی مواد لیگنوسلولزی را به اتانول تبدیل کنند که شناخته ترین آن ها عبارتند از: 1- اشریشیا کولای 2- زیموموناس موبیلیس 1- اشریشیا کولای مزایای متعددی دارد. مثلا می تواند طیف وسیعی از قندها را ازجمله دی گلوکز و ال – آرابینوز تخمیر کند، ساده بودن دست ورزی های ژنتیکی. با این حال، چندین ایراد بر آن وارد است: محدوده PH خنثی (6-8) باعث حساس شدن تخمیر باکتریایی به آلودگی می شود، تحمل کم به مهار کننده های مشتق از مواد لیگنوسلولزی، اتانول و تشکیل محصول مخلوط. 2- زیموموناس موبیلیس با استفاده از مسیر تخمیر اینتر- دودوروف دی گلوکز را اتانول تبدیل می کند. مقدار اتانول زیاد و ناخالصی توده سلولی خیلی کمی تولید می کند. اما ایرادهایی که دارد عبارتند از: دامنه PH طبیعی باریک و مقاومت کم به بازدارنده های حاصل از مواد لیگنوسلولزی. مقاومت به اتانول به تولید غلظت 12 تا 5/13 درصدی آن می شود. همچنین دامنه ی پیش ماده ی آن باریک بوده و بیشتر قادر تخمیر دی گلوکز است. مونو و دی ساکاریدهای حاصل از هیدرولیز مواد لیگنوسلولزی با توجه به نوع میکروب و شرایط محیطی مثل دما، غلظت بازدارنده ها و غیره به دو روش از غشاء میکروب های مخمر عبور می کنند: 1- انتشار تسهیل شده که براساس شیب غلظت عمل می کند 2- انتقال فعال (وابسته به شیب پروتونی، وابسته به انرژی حاصل از ATP، وابسته به فسفوانول پیرووات).
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 20 ارديبهشت 1392برچسب: تولید بیواتانول از همی سلولز, ] [ 10:34 ] [ حمیدرضا قاسمی ]
موجودات زنده ی یک اکوسیستم ممکن است با هم ارتباط داشته یا نداشته باشند. در حالتی که باهم ارتباط دارند، روابط آن ها به شکل های مختلفی است که یکی از آنها همزیستی باکتری های ریزوبیوم با ریشه ی گیاهان است که گاهی به تشکیل ساختاری به نام گرهک ختم می شود. در این ساختارها که عمر آن ها به گونه گیاهی و عوامل متعددی نظیر ژنوتیپ گیاه میزبان، ژنوتیپ میکروسیمبیونت ریزوبیالی، محیط رشد (میزان نیترات خاک، نسبت متابولیت های نیتروژن دار به متابولیت های کربن دار دمای بالا، شرایط اسیدی خاک، آلودگی ریشه به عوامل بیماریزا و خشکی و غیره) و رقابت گره و میوه جهت گرفتن انرژی و مواد قندی بستگی دارد، عمل تثبیت نیتروژن توسط باکتروئیدها صورت می گیرد. در گره ها یک شیب شعاعی نمو وجود دارد به طوری که پیری در مرکز آغاز شده و به سمت بیرون پراکنده و منتشر می شود. باکتری های درون سیمبیوزوم در هر دو نوع گرهک می توانند هنگامی که گرهک پیر می شود، دوباره به حالت باکتری های ساپروفیت بازگردند. برقراری همزیستی با ترشح موادی از سوی گیاه نظیر فلاونوئیدها شروع شده و اختصاصی بودن ارتباط توسط عوامل نود ترشح شده از طرف باکتری ها تعیین می شود. شکل گیری گره و تعیین تعداد آن ها و همچنین فعالیت آن ها توسط مسیرهای هورمونی (اتیلن، آبسزیک اسید و سیتوکینین) و متابولیتی کنترل می شود. بیشترین فعالیت تثبیت نیتروژن در هفته ی سوم عمر آن دیده می شود و به تدریج از فعالیت آن کاسته شده و تعداد پراکسیزوم ها افزایش، تعداد میتوکندری ها کاهش و پلاست ها در خود فریتین ذخیره خواهد کرد و فعالیت خود را نهایتا از دست می دهد. همچنین فعالیت تیول پروتئازها به ویژه سیستئین پروتئازها افزایش می یابد. گونه های فعال اکسیژن نقش های متعددی در سلول های گیاهی، جانوری و باکتریایی دارند که عبارتند از: مرگ برنامه ریزی شده ی سلولی، چرخه سلولی، به عنوان پیک ثانویه در پیام رسانی آبسزیک اسید و اتیلن، پاسخ ایمنی ذاتی (مانند پاسخ بسیار حساس) و ایمنی اکتسابی. دو فرضیه برای نقش گونه های فعال اکسیژن، آسکوربات و گلوتاتیون در پیری گرهک لگوم ارائه شده است: 1- کاهش تدریجی گلوتاتیون و آسکوربات می تواند به افزایش تدریجی تنش اکسیداتیو و آغاز پیری گرهک منجر شود. 2- کاهش تدریجی آسکوربات و گلوتاتیون گرهک طی پیری به افزایش تدریجی تنش اکسیداتیو منجر نمی شود زیرا با کاهش گونه های فعال اکسیژن همراه است و توازن ردوکس گرهک حفظ می شود. در هر دو حالت روابط پلاسمودسمایی از بین رفته و آسکوربات یا پیش سازهای گلوتاتیون که گره نمی رسد. زیرا گره به تنهایی به دلیل نداشتن آنزیم گالاکتونولاکتون دهیدروژناز، قادر به ساخت آنتی اکسیدان های آسکوربات و گلوتاتیون نیستند.
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 20 ارديبهشت 1392برچسب:پیری گرهک, ] [ 10:32 ] [ حمیدرضا قاسمی ]
فولدینگ پروتئین ها فرایندی است که طی آن ترادف خطی اسید های آمینه یک زنجیره پلی پپتیدی، ویژگی های ساختاری جهت تبدیل شدن به یک پروتئین فعال را کسب می کنند (9). رسیدن به ساختار فعال سبب می شود که پروتئین ها از نظر سطح انرژی به حالت پایدار برسند. فرایند فولدینگ پروتئین ها در طی تکامل به وسیله سیستم های پشتیبانی درون سلول ها توسعه یافته است. این سیستم ها شامل خانواده های پروتئینی بسیار حفاظت شده ای است که مولکول های چاپرون نامیده می شوند و در غلظت های زیاد در تمامی سلول های زنده یافت می شوند (8 و9). چاپرون ها فرایند فولدینگ متنوعی را درعمر پروتئین ها از سنتز آنها گرفته تا تجمع و انتقال آنها، عبور و مرور پپتیدها و تجزیه شدنشان هدایت می کنند (1). از آنجایی که شوک حرارتی سنتز این پروتئین ها را شدیداً القا می کند به آنها پروتئین های شوک حرارتی یا Hsp گفته می شود ودرشرایط استرسی درسلول بیان میگردند نقش این پروتئین ها جلوگیری از تغییر ساختاری پروتئینها تحت عوامل استرسی میباشند. بیان پروتئینهای Hsp بواسطه چندین نوع از عوامل استرس زا همچون استرسهای اکسیداتیو، فلزات سنگین، خشکی، نمک، مواد شیمیایی سمی و همچنین شرایطی که موجب جراحت و نکروزیس میگردد القاء میگردند (2). پروتئینهای Hsp از طرفی به جایگا ه های هیدروفوبیک روی پلی پپتیدها متصل گشته و سبب بروز تغییرات ساختاری در آنها میگردند و از سوی دیگر سبب جلوگیری از ایجاد پپتید هایی با فولدینگ اشتباه میگردند(6).5 خانواده اصلی چاپرونی در گیاهان که نقش اساسی درفولدینگ مجدد پروتئین ها دارند خانواده های Hsp70(Dnak)، sHsp، Hsp60(GroEL)،Hsp90 ، Hsp100 هستند. چاپرون ها با اتصال به بخش هیدروفوب پلی پپتید نوظهوریا پروتئینی که نیاز به فولد شدن مجدد دارد طی سیکلی با مصرف ATP ، تغییر ساختار داده و پروتئین را فولد می نمایند(8).
References 1. Barral, J. M., Broadley, S. A., Schaffar, G., Hartl, F. U. (2004). Roles of molecular chaperones in protein misfolding diseases. Cell Dev Biol. 15(1):17–29. 2. Boston, R. S., Viitanen, P. V., Vierling, E. (1996). Molecular chaperones and protein folding in plants. Plant Molecular Biology 32:191-222. 3. Geraldine, J., Mala, S., Rose, C. (2010). Interactions of heat shock protein 47 with collagen and the stress response: An unconventional chaperone model? Life Sciences 87: 579–586. 4. Hartl, F.U., Martin, J. (1995). Molecular chaperones in cellular protein folding. Curr Opin Struct. Biol. 5(1):92-102. 5. Hartl, F.U. (1996). Molecular chaperones in cellular protein folding. Nature 381: 571–579. 6. Houry, W. A. (2001). Chaperone-Assisted Protein Folding in the Cell Cytoplasm. Current Protein and Peptide Science 2: 227-244. 7. Karlin, S. and Brocchieri, L. (1998). Heat shock protein 70 family: multiple equence comparisons, function, and evolution. J. Mol. Evol. 47: 565–577. 8. Mogk, A., Matthias, Mayer, P., Deuerling, E. (2002). Mechanisms of Protein Folding: Molecular Chaperones and Their Application in Biotechnology. Chem Bio Chem 3: 807-814. 9. Walter, S., Buchner, J. (2002). Molecular Chaperones–Cellular Machines for Protein Folding. Angew. Chem. Int. Ed. 41: 1098- 1113. 10. Wickner, S., Maurizi, M. R., Gottesman, S. (1999). Posttranslational quality control: folding, refolding, and degrading proteins. Science. 286:1888-1893. 11. Zhang, X., Glaser, E. (2002). Interaction of plant mitochondrial and chloroplast signal peptides with the Hsp70 molecular chaperone . TRENDS in Plant Science Vol.7 No.1.
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ یک شنبه 18 فروردين 1392برچسب:مکانیسم مولکولی عمل چاپرون ها در فولدینگ پروتئین ها, ] [ 20:56 ] [ حمیدرضا قاسمی ]
تنش های غیر زیستی مثل شوری خاک، خشکی، درجه حرارت پایین، pH بالا و غلظت پایین کاتیون پتاسیم عوامل محیطی بحرانی هستند که به طور نامطلوبی بر رشد و نمو گیاه را محدود می کند. به دلیل عدم توان جا به جایی گیاهان، سازوکارهای تنظیمی دقیقی جهت درک، هدایت و پاسخ دهی به پیام های تنش زا در سطح مولکولی، سلولی و فیزیولوژیکی در آن ها تکامل یافته است. بسیاری از تنش ها باعث تغییرات فضایی و لحظه ای در غلظت کلسیم آزاد سیتوزول شده (اثر یا امضاء کلسیم نامیده می شود) که حسگرها این تغییرات را درک کرده و از طریق واکنش با پروتئین کینازها برای تنظیم بیان ژن های پاسخ دهنده به تنش، نقش خود را ایفا می کنند. در پاسخ گیاه به تنش های غیر زیستی غلظت کلسیم آزاد سیتوزول و پروتئین کینازها مانند یک کلید روشن – خاموش برای عمل ژن های پاسخگو به تنش عمل می کند. حسگرهای کلسیم به دو گروه تقسیم می شوند: ا- حسگرهای پاسخگو: پس از اتصال به کلسیم، از نظر ساختمانی تغییر شکل داده و فعالیت کینازی خود را تعدیل می کند یا اینکه از طریق واکنش های درون مولکولی عمل می کند. بهترین نمونه این گروه پروتئین کینازهای وابسته به کلسیم است که به اختصار CDPK نشان داده می شوند. 2- حسگرهای رابط (رله کننده): به کلسیم متصل می شوند اما فاقد فعالیت کینازی بوده و از راه واکنش با پروتئین کینازها فعالیت می کنند. دو نوع از این گروه در گیاهان شناخته شده که یکی کالمودولین و دیگری پروتئین شبیه کلسی نورین B ویژه گیاهان (سیستم CBL) است. در این سمینار ما در مورد سیستم تازه شناخته شده ی CBL تحقیق می کنیم. موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ پنج شنبه 8 فروردين 1392برچسب:حس گرهای کلسیم, ] [ 23:57 ] [ حمیدرضا قاسمی ]
درک و دریافت تنش آب به سرعت توسط گیاهان احساس می شود و به پیام های مولکولی که در آبشارهای پروتئین کنیازهای فعال شده با میتوژن، پروتئین فسفاتازها، فسفولیپیدهای پیام رسان و تعدیلات چندگانه پس از ترجمه نقش دارند، ترجمه می شود. این ژن ها برنامه ریزی مجدد رونویسی ژن های مسئول خشکی که برای طی کردن دوره خشکی و کم آبی ضروریند، القا می کنند. نهایتاً، فعال شدن مسیر پیام دهی تنش به تجمع اسمولیت های مختلف جهت غلبه بر شرایط کم آبی منجر می شود. تجمع پلی آمین ها به میزان زیاد در پاسخ به خشکی با نقش آن ها در حمایت گیاه در برابر خشکی همسوست. در سال های اخیر، مطالعات مولکولی و ژنتیکی سازوکارهای ویژه ای برای پلی آمین ها در حمایت در برابر خشکی و مسیرهای پیام دهی آشکار کرده اند. ما در بخش های بعدی یافته های جدید حاصله توسط گروه خودمان توضیح می دهیم که دال بر تنظیم متقابل پلی آمین ها با مسیرهای هورمونی تنش و زهکشی متابولیک پلی آمین در پاسخ به کم آبی است و این با متابولون که در بخش قبلی توضیح داده شد، موازی و همسوست. موضوعات مرتبط: اکولوژی، فیزیولوژِی گیاهی، ، برچسبها: [ چهار شنبه 11 بهمن 1391برچسب: پلی آمین ها در تنش خشکی, ] [ 16:46 ] [ حمیدرضا قاسمی ]
پلی آمین ها ترکیبات پلی کاتیونی کوچکی با وزن مولکولی کم هستند که در تمام موجودات زنده وجود دارند. فراوانترین پلی آمین ها دی آمینی به نام پوترسین (PUT)، تری آمینِ اسپرمیدین (Spd) و تترا آمین اسپرمین (Spm) است (شکل 1). حضور گروه های آمینی در ساختار شیمیایی آن ها در pH فیزیولوژیک بارهای مثبتی ایجاد می کند که پیوند شدن پلی آمین ها را با درشت مولکول های با بار منفی و فسفولیپیدها امکان پذیر می سازد. در تمام موجودات زنده، اولین پلی آمین ساخته شده پوترسین است که از راه آنزیمی و با آنزیم اورنتین دکربکسیلاز تولید می شود. گیاهان و باکتری ها یک مسیر دیگر برای تولید پوترسین از راه دکربکسیلاسیون آرژینین به کمک آنزیم آرژینین دکربکسیلاز دارند. در اثر فعالیت آرژینین دکربکسیلاز طی دو مرحله ی آنزیمی به کمک آنزیم های آگماتین ایمنوهیدرولاز و N–کربامویل پوترسین آمیدوهیدرولاز، آگماتین به پوترسین تبدیل می شود. وزن مولکولی بالای آمین ها با اضافه شدن متوالی بخش های آمینوپروپیل به اسکلت پوترسین از راه واکنش های آنزیمی (به کمک آنزیم های اسپرمیدین و اسپرمین سینتاز) به وجود می آید. دهنده گروه های آمینوپروپیل، S-آدونوزیل متیونین دکربکسیله شده است که از دکربکسیلاسیون S-آدونوزیل میتونین به کمک SAM دکربکسیلاز ساخته می شود. موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ چهار شنبه 11 بهمن 1391برچسب: بیوسنتز, کاتابولیسم و الحاق پلی آمین ها, ] [ 16:45 ] [ حمیدرضا قاسمی ]
لازم است که گیاهان نیتروژن را جهت رشد به طور کارآمدی از خاک به دست آورند. زیرا نیترات یکی از منابع اصلی نیتروژن برای گیاهان عالی است. آن ها نیترات را به دو شکل آلی (آمینو اسیدها، پپتیدها و پروتئین ها) و غیرآلی (نیترات، آمونیوم و اوره) جذب می کنند که غلظت این دو شکل نیتروژن به نوع خاک، درجه حرارت و فعالیت میکروارگانیسم ها بستگی دارد. چون گیاهان موجودات زنده ی غیر متحرکی هستند، نمی توانند محیط احاطه کننده خود را انتخاب کنند بلکه می توانند با آن سازگار شوند. بنابراین، آن ها دارای چندین سیستم جذب و انتقال جهت مطلوب ساختن و حمایت از رشد خود در پاسخ به شرایطی که به سرعت تغییر می کنند، هستند. بنابراین جذب نیترات و تخصیص آن از عوامل کلیدی و مهم در استفاده ی کارآمد از نیتروژن است. جذب نیترات از خاک و حرکات درون و برون سلولی در گیاه مستلزم ناقلین غشایی است. چهار خانواده ژنی، ü ناقل نیترات 1/ ناقل پپتید (PTR /1NRT) ü 2NRT ü کانال کلراید (CLC) ü کانال کندآنیونی همراه 1 همولوگ 3 (SLAH /1SLAC) در جذب، تخصیص و ذخیره در گیاهان عالی نقش دارند. مطالعات در مورد این ناقلین یا کانال ها، دیدگاه های جدیدی نسبت به سازوکارهای مولکولی جذب و تخصیص نیترات فراهم کرده اند. به طور قابل توجهی تعدادی از این ناقلین نقش های متنوعی در احساس نیترات، نمو گیاه، دفاع در برابر پاتوژن و یا پاسخ به تنش بازی می کنند. موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ چهار شنبه 11 بهمن 1391برچسب: جذب, تخصیص و پیام رسانی نیترات, ] [ 16:42 ] [ حمیدرضا قاسمی ]
مقدمه: مکانیسم جذب یون ها توسط سلول های گیاهی طی سال های اخیر مورد مطالعات دقیق قرار گرفته است. علی رغم آنکه ارتباط یونی بین سلول های گیاهی با محیط اطراف از چندین نظر با سلولهای جانوری اختلاف دارد، اما به طور کلی می توان از مطالب مربوط به الکتروفیزیولوژی سلول های جانوری و ویژگی های سلول های عصبی، برای سلول های گیاهی نیز استفاده نمود. از طرف دیگر کوچک بودن اندازه سلول های گیاهی، کار مطالعه آنها را مشکل می سازد. بنابراین دانشمندان اغلب در مطالعات خود از سلول های بزرگ جلبک های مختلف که دارای هستۀ مرکزی می باشند، استفاده می نمایند و شاید به همین دلیل اطلاعات در مورد جلبک ها از گیاهان بیشتر است. منبع پایگاه اینترنتی دکتر قلعه نویی موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب [ دو شنبه 20 شهريور 1391برچسب:فرآیند جذب در گیاهان, ] [ 9:54 ] [ حمیدرضا قاسمی ]
[ دو شنبه 9 مرداد 1391برچسب:فرم نحوه امتیاز دهی مرحله مصاحبه دکتری سراسری 91, ] [ 10:52 ] [ حمیدرضا قاسمی ]
گیاهان که منبع غذاها ، داروها و تعداد بیشماری از مواد آلی گوناگون هستند، در حقیقت گنجینهای عظیم از ثروت پنهانی بشمار میروند که پیوسته تجدید میشوند. گیاهان علاوه بر آنکه نقش تلمبه آب بیاندازه پرتوانی را میان خاک و جو ایفا میکنند. با بقایای فسیلی خود منشا منابع لازم برای تمدن کنونی هستند. سلول گیاهی آزمایشگاه بنیادی این کارخانه شگرف ترکیبات آلی است. مهم آن است که تعیین شود گیاه با چه فرآیندهایی (فتوسنتز، تعرق و (واکنشهای متابولیسمی|متابولیسم)) دگرگونیهای متعددی را باعث میشود که از چند ماده ساده آغاز میشوند و به تعداد بیشماری از پیچیدهترین مواد آلی حاصل از متابولیسم گیاهی میرسند.
منبع: سایت بی بوک موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب [ جمعه 6 مرداد 1391برچسب:بیوشیمی گیاهی, ] [ 12:41 ] [ حمیدرضا قاسمی ]
فیزیولوژی دانشی است که وظیفهاش بررسی عملکرد (Function) موجودات زنده است. ماهیت بررسی در این علم ، وظیفه و کارکرد اندامهاست. نام قدیمی فیزیولوژی وظایفالاعضا بوده است. فیزیولوژی گیاهی ، مطالعه اعمال حیاتی گیاه ، فرایندهای رشد و نمو ، متابولیزم و تولید مثل گیاهان است. منبع:
سایت بی بوک
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب [ جمعه 6 مرداد 1391برچسب:فیزیولوژی گیاهی, ] [ 12:31 ] [ حمیدرضا قاسمی ]
برای دانلود سرفصل های دروس مقطع دکتری زیست شناسی گیاهی، روی نام آن ها کلیک کنید. منبع: http://www.sbu.ac.ir/Default.aspx?tabid=5150 موضوعات مرتبط: اکولوژی، تکوین گیاهی، فیزیولوژِی گیاهی، سیستماتیک گیاهی، ، برچسبها: [ پنج شنبه 5 مرداد 1391برچسب:سرفصل های دروس مقطع دکتری زیست شناسی - فیزیولوژی گیاهی, سلولی و تکوین گیاهی و سیستماتیک گیاهی, ] [ 23:46 ] [ حمیدرضا قاسمی ]
مکانیزمهای فعال و غیرفعال پیشنهادی جهت توجیه انتقال در آوند آبکش نظریات مرتبط با انتقال در آوند آبکش را می توان به دو دسته فعال و غیرفعال تقسیم بندی کرد. فرض هر دو نوع نظریه بر این است که بارگیری در منبع و جذب در مخزن مستلزم صرف انرژی است با این تفاوت که نظریات فعال معتقد به صرف انرژی برای فرایند انتقال هستند و حال آنکه نظریات غیرفعال بر این باورند که انرژی، تنها برای حفظ کارایی عناصر غربالی و نه برای تحریک فرایند انتقال لازم است. یکی از اصلی ترین نظریات فعال آن است که مواد محلول موجود در یک سوی عنصر غربالی، به کمک جریانهای سیتوپلاسمی و حرکتهای دورانی پروتوپلاسم، به سوی دیگر آن حرکت کرده و از طریق برخی مکانیزمهای ناشناخته از خلال صفحه غربالی عبور می کنند. از آنجا که هرگز جریانهای سیتوپلاسمی در عناصر غربالی بالغ و درحال کار رویت نشده است لذا باید این نظریه را مردود دانست. افزون بر این هیچ شاهدی مبنی بر حضور رشته های نازک اکتین، که در عمل جریانهای سیتوپلاسمی در سایر سلولهای گیاهی دخیلند وجود ندارد. مدل فعال اولیه دیگر برای انتقال در آوند آبکش بیانگر آن است که پروتئین P، همانند رشته های نازک اکتین در ماهیچه ها و میکروتوبولها در مژکداران و تاژکداران، قادر است از طریق برخی حرکات دودی و انقباضی، نیروی محرکه لازم برای حرکت مواد محلول را فراهم سازد، هر چند که شواهدی مبنی بر شباهت پروتئینP به اکتین یا توبولین وجود ندارد.
نوع دوم نظریه فعال بر این اعتقاد است که انرژی سبب می شود که مواد محلول از طریق صفحه غربالی، از یک عنصر غربالی به عنصر دیگر راه یابند. براساس تصاویر الکترونی بافت آبکش، این گونه به نظر می رسد که منافذ صفحه غربالی عموماً با کالوز و پروتئین P مسدود می شوند، لذا وجود مکانیزم انتقال فعال مواد محلول الزامی است. اگر به هنگام کار، منافذ صفحه غربالی واقع در بین دو عنصر غربالی بسته شوند، آن گاه مدلهای غیرفعال انتقال بر مبنای جریان توده ای مواد محلول، غیرممکن خواهد بود. اما انسداد ظاهری منافذ صفحه غربالی در این تصاویر، مصنوعی و ناشی از روش تثبیت نمونه می باشد به هنگام کار، منافذ صفحه غربالی واقعاً بازند و بنابراین وجود مکانیزم انتقال فعال مواد حل شونده از صفحات غربالی ضرورتی ندارد.
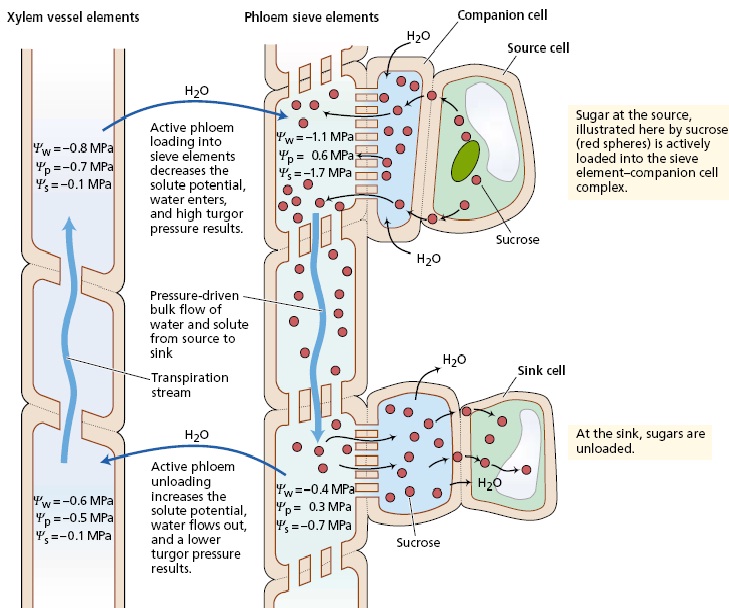
براساس فرضیه جریان فشار، انتقال در آوند آبکش به کمک شیب فشار از منبع به مخزن انجام می گیرد نظریات غیرفعال انتقال، فرضیات انتشار و جریان فشار را شامل می شوند. انتشار کندتر از آن است که بتوان روی سرعت حرکت مواد محلول مشاهده شده در آوند آبکش تاکید کرد سرعت انتقال در آوند آبکش 1 متر در ساعت است، حال آنکه سرعت انتشار 1 متر در 8 سال می باشد! از سوی دیگر، فرضیه جریان فشار به عنوان محتمل ترین مکانیزم انتقال در آوند آبکش پذیرفته شده است این فرضیه نخستین بار به وسیله مانچ در سال 1930 ارائه شده و بیانگر آن است که جریان محلول در عناصر غربالی، تحت اثر اختلاف شیب فشار بین مخزن و منبع صورت می گیرد. اختلاف فشار به دلیل انجام بارگیری در منبع و تخلیه در مخزن تداوم می یابد. بارگیری آوند آبکش سبب افزایش فشار اسمزی عناصر غربالی در بافت منبع شده و این امر افت شدید پتانسیل آب را در پی دارد. در پاسخ به این شیب پتانسیل آب آب وارد عناصر غربالی می شود و فشار تورژسانس آن را افزایش می دهد. در انتهای مسیر انتقال، تخلیه موجب کاهش فشار اسمزی عناصر غربالی در بافت مخزن می شود. همزمان با افزایش پتانسیل آب آوند آبکش و برتری آن بر آوند چوبی، آب در پاسخ به شیب پتانسیل آب، آوند آبکش را ترک می کند و این امر، کاهش فشار تورژسانس عناصر غربالی آبکش مخزن را در پی دارد. اگر در طول مسیر انتقال هیچ دیواره ای وجود نداشت (که وجود دارد) و اگر تمام مسیر انتقال یک جزء غشایی واحد بود آنگاه اختلاف فشار منبع و مخزن به سرعت به تعادل می رسید، اما وجود صفحات غربالی مقاومت مسیر را به شدت افزایش می دهد و منجر به تولید و حفظ اختلاف فشار بین عناصر غربالی منبع و مخزن می شود. از دیدگاه فیزیکی، جریان توده ای درست همانند حرکت آب از درون یک لوله آبرسانی، محتویات عناصر غربالی را در طول مسیر انتقال به جلو می راند. توجه کنید که براساس این مدل، در سرتاسر گیاه مقداری از آب بین مسیرهای تعرق (آوند چوبی) و انتقال ( آوند آبکش) در حال چرخش است. از بررسی دقیق مقادیر پتانسیل آب در این گونه بر می آید که حرکت رو به بالای آب در آوند آبکش تحت اثر شیب پتانسیل آب از منبع به مخزن صورت می گیرد این حرکات آب، قوانین ترمودینامیک را لغو نمی کند، چرا که حرکت آب بیشتر به کمک جریان جرمی و نه پتانسیل اسمزی، صورت می گیرد. ضمن انتقال مواد از یک لوله غربالی به لوله دیگر، هیچ غشایی قطع نمی شود و مواد نیز با سرعتی معادل سرعت آب حرکت می کنند. تحت چنین شرایطی، فشار اسمزی، گرچه پتانسیل آب را تحت تاثیر قرار می دهد، اما هیچ نقشی در ایجاد نیروی محرکه لازم برای حرکت آب ندارد. بنابراین حرکت آب در مسیر انتقال بیشتر براساس شیب فشار و نه شیب پتانسیل آب صورت می گیرد. البته بدون هیچ تردیدی انتقال فشاری غیرفعال در مسیرهای طولانی در لوله های غربالی تماماً به مکانیزمهای انتقال فعال دخیل در بارگیری و تخلیه آوند آبکش وابسته است. این مکانیزمهای فعال، مسئول برقراری شیب فشار در اولین نقطه هستند. پیشگوییهای از مدل جریان فشاری از آنجا که فرضیه جریان فشاری مورد قبول عموم است، باید در ارتباط با پیشگوییهای مبتنی بر این مدل، به برخی نکات توجه کرد اول آنکه منافذ عناصر غربالی نباید بسته باشند چرا که اگر پروتئین P یا هر ماده دیگر این منافذ را مسدود کند، مقاومت در برابر جریان عناصر غربالی به سرعت افزایش می یابد. دوم آنکه در یک عناصر غربالی واحد انتقال دو جهته واقعی ( یعنی انتقال در هر دو جهت) رخ نمی دهد. جریان توده ای محلول، مانع از انتقال دو جهته می شود، چرا که در یک لوله، محلول تنها می تواند در یک جهت حرکت کند! در آوند آبکش، حرکت دو جهته مواد محلول تنها در دستجات آوندی مختلف یا عناصر غربالی متفاوت میسر است سوم اینکه با توجه به فرضیه جریان فشاری که یکی از نظریات غیرفعال است صرف انرژی زیاد برای انتقال مواد در بافتهای مسیر لازم نیست. در این مسیر، انرژی تنها برای نگهداری ساختمان عناصر غربالی و سلامت غشای سلول لازم است بنابراین چنانچه در بافتهای مسیر، تیمارهایی نظیر درجه حرارت کم، اکسیژن کم و بازدارنده های متابولیکی که فراهمی ATP را کاهش می دهند اعمال شود. نباید انتقال متوقف شود. توجه داشته باشید که در ارتباط با وابستگی مکانیزم انتقال انرژی، دلیلی در دست نیست که مواد بازدارنده، انتقال را از طریق اضمحلال ساختمانی غشا و سلول و نه تنها از طریق کاهش فراهمی ATP متوقف می سازند. سلامت و کارایی غشای سلول برای حفظ مواد محلول در جریان انتقال و باز بودن منافذ صفحه غربالی برای جرکت رو به جلو این جریان لازم است. چهارم آنکه فرضیه جریان فشاری به وجود یک شیب فشار مثبت نیاز دارد بدین منظور باید فشار تورژسانس عناصر غربالی منبع، بیشتر از عنار غربالی مخزن باشد و اختلاف فشار نیز به اندازه باشد که بر مقاومت مسیر غلبه کرده و مواد را با سرعتی معادل آنچه اندازه گیری شده، حرکت دهد.
ممکن است مکانیزم انتقال در آوند آبکش بازدانگان با نهاندانگان متفاوت باشد سلولهای غربالی بازدانگان، از بسیاری جهات مشابه اجزای لوله های غربالی بازدانگان می باشند البته سطوح غربالی سلولهای غربالی نسبتاً غیرتخصصی هستند و به نظر نمی رسد که دارای منافذ باز باشند این منافذ به وسیله غشاهای متعددی که به شبکه آندوپلاسمی صاف مجاور سطوح غربالی متصلند، پر شده اند. قطعاً چنین منافذ با نیازهای فرضیه جریان فشاری تضاد دارد. به هر حال یا این تصاویر الکترونی با مشکلی در فرایند تثبیت همراه هستند و یا مکانیزم دیگری درانتقال بازدانگان ایفای نقش کرده است که شاید شبکه آندوپلاسمی در آن نقش مهمی دارد.
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ چهار شنبه 4 مرداد 1391برچسب: مکانیزم انتقال در آوند آبکش, ] [ 11:48 ] [ حمیدرضا قاسمی ]
سلولهاي زنده آبكش، مواد غذايي مثل قندها را از طريق پلاسمادسماتا (Plasmodesmata) به ساير سلولها و اندامهاي گياه منتقل مي نمايند. بافت آبكش از عناصر آوند آبكش و سلولهاي همراه تشكيل شده است. آبكش از سلولهاي مادر لايه كامبيوم كه سلولهاي چوبي را نيز توليد مي كنند بوجود مي آيد. آبكش مانند چوب داراي الياف و سلولهاي پارانشيمي و سلولهاي شعاعي مي باشد. عناصر آوند آبكش شبيه عناصر چوبي از هر دو انتها بر هم منطبق بوده و لوله هاي آبكش را بوجود مي آورند. ولي بر خلاف عناصر چوبي ديواره انتهايي كاملا باز نبوده ولي در عوض پر از منفذهاي كوچكي هستندكه از درون آنها سيتوپلاسم از سلولي به سلول ديگر منتقل مي شود. اين مناطق منفذدار آوند آبكش، صفحات آبكش ناميده مي شوند. عناصر آبكش هنگام بلوغ بدون هسته مي باشند، ولي علارغم اين واقعيت سيتوپلاسم آنها براي انتقل مواد غذايي به صورت محلول در سراسر گياه بسيار فعال است. ظاهرا سلولهاي همراه ارتباط خيلي نزديكي با لوله هاي آبكش دارند و باعث انتقال غذا مي شوند. انتقال شیره پرورده براساس تئوری فشار اسمزی صورت می گیرد. ابتدا در منبع قندها به صورت فعال وارد آوندهای آبکش منبع شده سپس پتانسیل اسمزی در این آوندها افزایش یافته و آب مورد نیاز خود را از آوندهای چوبی گرفته و فشار افزایش یافته و مواد قندی و دیگر مواد موجود در آوند آبکش براساس شیب فشار به سمت مخزن حرکت کرده و در آنجا پس از تخلیه پتانسیل اسمزی مثبت تر شده و آب اضافی مجددا وارد آوند چوبی می شود. موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 30 تير 1391برچسب:مشخصات بافت آبکشي را به طور مختصر نوشته و مکانيسم حرکت مواد در آن را توضيح دهيد, , ] [ 18:6 ] [ حمیدرضا قاسمی ]
فضای آپوپلاستي به دو بخش فضای آزاد پخش (آب) و فضای آزاد دونان تقسیم می شود که در بخش اول مکانیسم حرکت یونهای معدنی صرفا شیب غلظت بوده و به تعادل می رسد و اگر ریشه در آب مقطر قرار گیرد تمام یونهای جذب شده به آب مقطر برمی گردد. اما در بخش دوم، یونه به ویژه کاتیونها جذب بارهای منفی ماکرومولکولهای تشکیل دهنده دیواره شده و تراکم آنها افزایش یافته و میزان جذب آنها افزایش می یابد. موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 30 تير 1391برچسب:انتقالات غيرفعال و قلمروهاي آنها را بنويسيد,, ] [ 18:5 ] [ حمیدرضا قاسمی ]
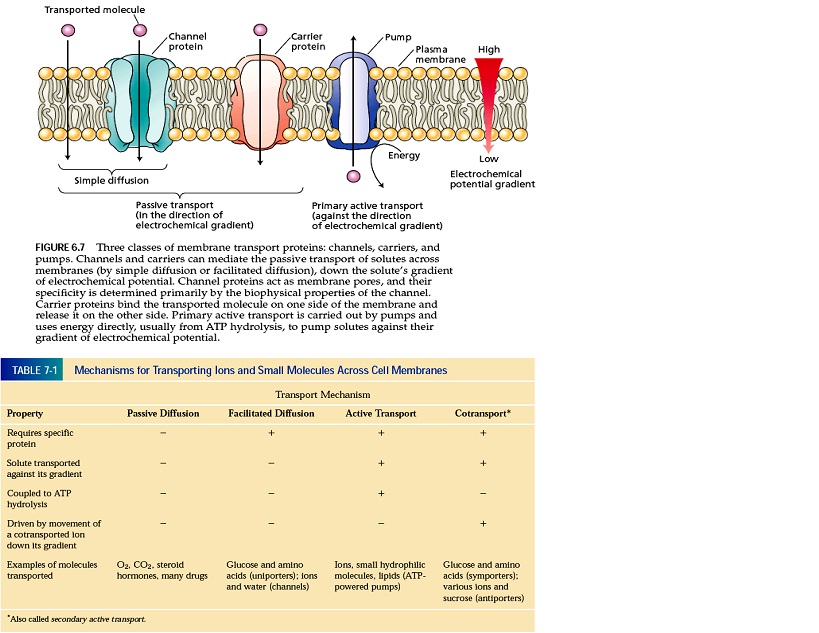
انتشار از خلال غشاء به صورت غیرفعال، در جهت شیب الکتروشیمیایی صورت گرفته و به دو بخش ساده و تسهیل شده تقسیم می شود. در انتشار تسهیل شده پروتئین های غشایی اعم از کانال ها (دایمرهای پروتئینی انتگرال غشایی با سرعت بالا 106 الی 108) و ناقل ها که در اثر تغییر شکل خود باعث انتقال مواد از خلال غشاء می شوند، نقش دارد. ناقل ها به عنوان یونی پورترها شناخته می شوند و دارای سرعتی برابر 102 الی 104 مولکول در ثانیه است. از کانال ها می توان به آکواپورین ها که حرکت آب را از غشاء سلول تسهیل می کند و این مسیر اول انتقال آب است و مسیر دوم، انتشار ساده از لابه لای غشای لیپیدی صورت می گیرد. از ناقل ها می توان به انتشار گلوکز و اسیدآمینه از عرض غشاء پلاسمایی سلول های پستانداران، اشاره کرد. موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 30 تير 1391برچسب:انتشار تسهيل شده چيست؟ و در چه سطوحي مي تواند عمل کند, با ذکر مثال آن را توضيح دهيد,, ] [ 18:2 ] [ حمیدرضا قاسمی ]
فضای آپوپلاستي به دو بخش فضای آزاد پخش (آب) و فضای آزاد دونان تقسیم می شود که در بخش اول مکانیسم حرکت یونهای معدنی صرفا شیب غلظت بوده و به تعادل می رسد و اگر ریشه در آب مقطر قرار گیرد تمام یونهای جذب شده به آب مقطر برمی گردد. اما در بخش دوم، یونه به ویژه کاتیونها جذب بارهای منفی ماکرومولکولهای تشکیل دهنده دیواره شده و تراکم آنها افزایش یافته و میزان جذب آنها افزایش می یابد. موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 30 تير 1391برچسب:انتقال آپوپلاستي يون هاي معدني وآب را در سطح ريشه توضيح داده و موانع اين انتقال را بنويسيد,, ] [ 18:0 ] [ حمیدرضا قاسمی ]
انتقال از عرض غشاء به دو صورت فعال (اوليه که به طور مستقيم وابسته به ATP، انتقال فعال ثانويه به طور غير مستقيم وابسته به ATP) و غير فعال (انتشار ساده وتسهيل شده به کمک پروتئين هاي غشائي اعم از کانال ها يا ناقل ها) صورت مي گيرد که در نوع دوم نيازي به مصرف انرژي نيازي نيست زيرا انتقال از غلظت بالاتر به غلظت پايين تر صورت مي گيرد. اما در نوع اول انتقال مواد، به مصرف انرژي نياز است زيرا مواد برخلاف شيب الکتروشيميايي (شيب غلظت و شيب الکتريکي) منتقل مي شود. منابع انرژي مورد نياز نيز به سه دسته تقسيم مي شود: الف- هيدروليز ATP ب- انرژي حاصل از واکنش هاي اکسيد و احياء نظير زنجيره انتقال الکترون در ميتوکندري و کلروپلاست. ج- گرفتن انرژي نور توسط مولکول ناقل مثل باکتريوردوپسين موجود در غشاء سلول هاي باکتريايي با جذب نور پروتون ها را از سيتوپلاسم خارج کرده و هنگام بازگشت اين پروتون ها يک نيروي مفيد (نيروي محرکه پروتوني يا PMF) براي ورود مواد موردنياز برخلاف شيب الکتروشيميايي (انتقال فعال ثانويه) مي تواند مورد استفاده قرارگيرد.
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 30 تير 1391برچسب:منابع انرژي لازم براي انتقال غشايي چگونه تامين مي شود؟ , ] [ 17:40 ] [ حمیدرضا قاسمی ]
موضوعات مرتبط: کنکور، دانشگاه، اکولوژی، تکوین گیاهی، فیزیولوژِی گیاهی، سیستماتیک گیاهی، ، برچسبها: [ سه شنبه 2 خرداد 1391برچسب:دانلود رایگان سوالات دکتری نیمه متمرکز 91 , زیست شناسی, انگلیسی, استعداد تحصیلی, ] [ 12:19 ] [ حمیدرضا قاسمی ]
به معنای وسیع آن به هر عامل یا ترکیبی از عوامل محیطی اطلاق میگردد که باعث شود گیاه نتواند به اندازه توان بالقوه ژنتیکی خود رشد کند. به عبارت دیگر تنش عبارت است از هر گونه تغییر در عوامل طبیعی نسبت به شرایط بهینه رشد گیاه که رشد و نمو را کاهش و یا به طور نامطلوب تغییر داده و موجب کاهش رشد و عملکرد گیاه گردد. در بیشتر موارد تنش به عنوان دور شدن از شرایط معمول زندگی و ایجاد تغییرات و واکنشهایی در کلیه سطوح عملکرد در نظر گرفته شده است، این تغییرات قابل برگشت بوده و یا مکن است پایدار باقی بماند.
برای ادامه مطلب روی لینک زیر کلیک کنید: http://ecology.persianblog.ir/post/165/
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: [ دو شنبه 28 فروردين 1391برچسب: تنش های محیطی, ] [ 11:25 ] [ حمیدرضا قاسمی ]
این سوال در چندین دوره ی آزمون دکتری مطرح شده و پاسخ آن فقط برای اعضاء قابل روئیت خواهد بود. لطفا به صورت رایگان عضو شوید.
موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب [ دو شنبه 28 فروردين 1391برچسب:چگونه پتاسیم (در سطح مولکولی) توسط ریشه گیاه جذب می شود؟, ] [ 11:19 ] [ حمیدرضا قاسمی ]
گونه هاي فعال اکسيژن و تنفس گياهي (Reactive Oxygen Species (ROS) and Plant Respiration) گونه هاي فعال اکسيژن نتيجه اجتناب ناپذير تنفس هوازي است. هنگامي که اکسيدازهاي انتهايي (سيتوکروم c اکسيداز و اکسيداز جايگزين) با اکسيژن واکنش مي کنند، چهار الکترون منتقل شده و آب توليد مي شود. در هرحال، گهگاه اکسيژن مي تواند با ديگر اجزاء انتقال الکترون واکنش کند. اما در اين حالت، فقط يک الکترون منتقل مي شود و به توليد آنيون سوپراکسيد (O2-) منجر مي شود. تخمين زده مي شود که در بافت هاي گياهي يک تا دو درصد اکسيژن مصرف شده به تشکيل آنيون سوپراکسيد منجر مي شود (1998Puntarulo et al,). در بين واکنش هاي متنوع ممکن، سوپراکسيد به پراکسيد هيدروژن، راديکال هاي هيدروکسيل و ديگر شکلهاي فعال اکسيژن که همه آنها مي توانند از راه هاي گوناگون باعث آسيب ديدگي و خسارت شوند، تبديل مي شود. زنجيره هاي جانبي پروتئين تغيير يافته و حتي محور اصلي ممکن است شکسته شود. به عنوان مثال، اسيدهاي چرب سيرنشده موجود در ساختمان ليپيدهاي غشاء مورد هجوم واقع شده، مشتقات پراکسيد تشکيل شده و سرانجام به شکسته شدن محور اصلي اسيد چرب ختم مي شود. در نهايت، شکلهاي فعال اکسيژن با مولکول DNA واکنش کرده و باعث جهش مي شوند. موضوعات مرتبط: تکوین گیاهی، فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب [ جمعه 18 فروردين 1391برچسب: گونه هاي فعال اکسيژن و تنفس گياهي (Reactive Oxygen Species (ROS) and Plant Respiration), ] [ 17:44 ] [ حمیدرضا قاسمی ]
رنگدانه ها و مواد آروماتيك در گلها و ميوه ها ،حشرات ، پرندگان و ديگر حيوانات را جذب ميكند كه گلها را تلقيح كرده يا ميوه ها را پراكنده كند ((zoochory. از آنجاببكه دو طرف شراكت (گياهان و جانوران) از اين رابطه سود مي برند (عمل جذب كنندگان بعنوان همزيست). رنگ گلها (گلبرگ، بساك،دانه گرده) ميوه ها از رسوب تركيبات رنگي در غشاهاي زيستي (كارتنوييد ها) و ديواره هاي سلولي (فلوبافنهاي قهوه اي ،ملانين سياه) و از رنگدانه هاي قند دار محلولدر خود رنگ به چندين عامل بستگي دارد: 1-نوع ساختار كروموفور(شكل 15-1)ساختار فلاون در فلاونوييدها ، ساختار بتايين دربتاسيانين و بتازانتين ها 2 - نوع جانشيني در ساختار پايه 3- كمپلكس ممكن باند شده به Fe+3 و AL+3 4 ـ pH شيره گياهي
به اين ترتيب درجات متفاوت رنگ بين دامنه اي از كرم،زرد ، زرد كمرنگ ، قرمز، آبي و ارغواني غليظ تغيير ميكند (جدول 5ـ1).نشانهاي شهد ماوراء بنفش بر روي گلها به وسيله همنوپتران و برخي از ديپترا (دوبالان) قابل تشخيص است. پرندگان با رنگهاي روشن و ماوراء بنفش منعكس شده توسط لايه هاي مومي سطح ميوه هاي خاصي جذب مي شوند .مواد آروماتيك حشرات ، پرندگان و پستانداران را به سوي گلها و ميوه ها دقيقاََ وقتي كه گلها باز ميشوند و ميوه ها مي رسند، جذب مي كند. انتشار عطر معمولاََ با فعاليتهاي روزانهَ حيوانات گرده افشان (پروانه ، زنبور) يا ميوه خواران هم زمان است (شكل 16-1).انتشار عطر يا بو به وسيله گياهان پيامي براي آمادگي جهت گرده افشاني است. بوهاي منتشر شده تقريباََ هميشه مخلوطي از متابوليت هاي ثانويه گياهي است به ويژه منوترپنها (روغنهاي اترال) الكلهاي زنجيري ، كتونها ، اترها ، اسيدهاي چرب، آروماتيكها (وانيلين،يوگنول) ،آمين ها و مشتقات ايندولها . يك مورد غير معمول گرده افشاني با جذب فوق العاده ويژه گرده افشانها توسط گونه هاي Ophrys وجود دارد. ترپنوييد هاي حلقوي ساطع شده از گلهاي اركيد فرومونهاي جنسي زنبورهاي وحشي را تقليد مي كنند.حركات جماع نرهاي گول خورده انتقالات پيچيدهَ دانه گرده به كلاله را با موفقيت فراهم ميكند. موضوعات مرتبط: اکولوژی، فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 18 فروردين 1391برچسب: جذب گرده افشانها و پراكند گي ميوه ها توسط حيوانات, ] [ 17:33 ] [ حمیدرضا قاسمی ]
گياهان مواد وترشحات متنوعي توليد مي كنند كه به طور منظم اثراتي را وقتيكه توسط ديگرگياهان،ميكرواورگانيسمها يا حيوانات جذب مي شوند،اعمال مي كنند. به طور طبيعي مواد بيو اكتيوي وجود دارند كه به عنوان ecomones يا Infochemicales شناخته مي شوند ونقشهاي مهمي در ايجاد انتقال پيامها،شناسايي،دفاع،ممانعت وتوليد سم بازي مي كند. برخي از اين عوامل فقط به صورت برون گونه اي به عنوان آتوتوكسين،ممانعت كننده در جوانه زني وبه عنوان فرومونها(جذب كننده وعلايم جاده اي)عمل مي كنند. درصورتيكه گروه ديگركه Allelochemicales ناميده مي شوند، برديگر گونه هاي گياهي،ميكرواورگانيسمها وحيوانات اثر مي كند. گروهي از اينفوكمكالها كه Allelomones ناميده مي شوند، فقط براي اورگانيسمهاي توليدكننده مفيد هستند،Kairomones گروه ديگري هستند كه فقط براي مصرف كنندهها مفيد هستند و Synomones براي دو طرف (شركا) مفيد هستند. طبيعت اغلب واكنشها نا معلوم ونسبتا پيچيده است،بنابراين مشكل است كه اثرات مواد بيواكتيورا بدون ابهام وصريح طبقه بندي كنيم. درك صحيح ما از واكنشهاي شيميواكولوژيكي براي فهم مااز فرايندهاي اكوسيستم وبراي پيشرفت اكولوژيكي دراندازه گيري درست بقا گياه لازم است.مواد بيواكتيو گياهي اغلب مواد واسطه يا محصولات نهايي متابوليسم ثانويه است. بنابراين آنها به عنوان مواد ثانويه گياهي معرفي مي شوند.آنها به صورت زيستي از پيشروهاي حاصله از متابوليسم اوليه سنتز شده اند. (شكل1-12)مهمترين راههاي سنتزي آنهايي هستند كهاز متابوليسم قند وچربي از طريق استيل كوانزيم آ،موالونات،ايزوپنتنيل پيروفسفات بهترپنوييد و استروييدها،از متابوليسم آمينواسيد و قند از طريق اسيد شيكميك وراه استات پلي كيتيد به تركيبات فنولي ومشتقاتشان(مثلافنيل پروپانها،فلاونوييدها،تاننها،موادگوناگون گلسنگ)واز طريق آمينو اسيدها به الكالوييدهامنتج مي شود. تخمين زده مي شود كه صد هزار مواد طبيعي اكوبيوشيميايي فعال وجود دارند. جدول(3-1) خلاصه اي از مهمترين گروههاي موادوانتشار(پراكندگي)تاكسونوميك آنهافراهم مي كند. تنوع موادثانويه گياهي درطول فيلوژني گياهي افزايش يافت ودر اثر فعل وانفعالات با پارازيتهاي ميكروبي وحيوانات مصرف كننده كامل شد. از آنجاييكه متخصصين مكررا درموردتمام انواع مواد دفاعي و توكسينهاي به توافق رسيده اند،تغييرات يا سنتز مواد جديد بايستي به طور مداوم پديدار شود. اين سازگاريهاي طبيعي در مدت نسبتا كوتاهي رخ مي دهد.اينها بديهي است كه پراكندگي شيميواكوتيپهاي متفاوت و اكوتيپهاي قابل تشخيص شيميوتاكسنومي(مثل تفاوتهاي بين عطر گونه هاي متفاوت لامياسه)قابل ملاحظه است. تركيبات عمومي فنيل پروپان (رزينها، ليگنين شكل 14-1)مشتقات فنولها (تاننهاي غليظ شده) و فلاونوييدهاي اولين مواد دفاعي شيميايي بودند كه استخراج شدهاند.(شكل13-1)طيف مواد طبيعي به ميزان زيادي با محصولات رده استات-موالونات افزايش يافت وقتي كه آنژيواسپرمها (نهاندانگان) تكامل يافتند و فرمهاي علفي پديدار شدند. كميت (اندازه)اينفوكمكالها در گياهان بين بافتها ، اندامها و حتي سلولهاي افراد متفاوت است. (عناصر ترشحي و تانن ايديوبلاستها) آنها در طول پيشرفت گياه و فصول متفاوت تغيير مي كنند. غلظت مواد بيوژنتيك گياهي ممكن است به ميزان قابل ملاحظه اي در طول روز يا حتي ساعت تغيير كند (نوسان كند). حالات غذايي گياه و اثرات ايجاد كنندهاي استرس متفاوت باعث تغيير قابل ملاحظه اي در كميت و تركيب (جدول 4-1) infochemical ها شده كه به نوبه خودفرايند هاي اكوسيستمها را تحت تاثير قرار مي دهد. حشرات بيشتر به گياهان استرس ديده و گياهاني كه به قدر كافي ذخيره نيتروژن دارند حمله مي كنند ، گياهان اساساًَ با افزايش توليد مواد دفاعي پاسخ مي دهند. روابط بيشمار از طريق انتقالات شيميايي بين ارگانيسم ها عمل مي كننذ. بنا بر اين تعدادي از وسيعترين و مهمترين پديده ها در زير توصيف ميشوند: موضوعات مرتبط: اکولوژی، فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 18 فروردين 1391برچسب: واكنشهاي شيميايي توسط مواد بيواكتيوگياه تغيير مي كند, ] [ 17:31 ] [ حمیدرضا قاسمی ]
ديواره گياهي به رسوباتي عمدتا پلي ساكاريدي اطلاق مي شود كه بر روي سطح بيروني غشاي سلولي قرارگرفته است. طبيعتا اولين سلول هايي كه ابتدا به وجود آمده اند، فاقد ديواره بوده اند و كسب ديواره در دوران تكامل اتفاق افتاده است. در دوران تكامل براي اولين بار، ديواره در باكتر ها شكل گرفته است. اين ها داراي ديواره هاي پپتيدوگليكاني بوده يعني از پروتئين و پلي ساكاريد ساخته شده و نحوه تشكيل ديواره در باكتري ها به صورت درون رو يا سانتري پت است. مواد وراثتي ابتدا دوبرابر شده، سپس بين دو سلول حاصله تقسيم مي شود. در باكتري ها تقسيم به صورت مستقيم (آميتوز) است. يعني ابتدا مواد وراثتي به نقطه معيني از ديواره متصل شده و پس از همانندسازي ديواره بين دو مولول وراثتي حاصله توسعه يافته و ديواره جديد دو مولكول وراثتي را از هم جدا مي كند. در خلال تكامل، هنگامي كه پروكاريوت ها به يوكاريوت ها تبديل مي شوند، موجوداتي نظير قارچ ها داريم كه يوكاريوت بوده ولي در آن ها ديواره به صورت سانتري پت شكل مي گيرد. قارچ هاي سيفومايست فاقد ديواره عرضي بوده و سيفوني هستند. اگر ديواره عرضي هم داشته باشند، سوراخ دار است. در قارچ هاي پيشرفته تر مثل آسكوميست ها كه هيف دارند، ديواره عرضي وجود داشته و سوراخ دار بوده كه اين سوراخ ها توسط اجسام پروتئيني (Plug) باز يا بسته مي شوند. ديواره سلولي در گياهان به صورت مركز گريز يا سانتريفيو ساخته شده و با توجه به گونه گياهي و رتبه تاكونوميكي آن متفاوت است. به طور كلي از سه لايه به نام هاي تيغه مياني، ديواره اوليه (كه در تمام سلوهاي گياهي وجود دارد) و ديواره ثانويه كه خاص سلول هاي تمايزيافته مثل آوندهاي چوبي است. البته در برخي سلول ها ديواره ديگري بر روي ديواره ثانويه به نام ديواره ثالثيه تشكيل مي شود. تيغه مياني بيشتر از پكتات كلسيم ساخته شده ولي ديواره اوليه از سلولز، همي سلولز و پروتئين هاي آنزيم و ساختماني مثل اكستنسين و اكسپنسين ساخته شده است و تعداد لايه هاي آن حداكثر چهار عدد مي باشد. تعداد لايه هاي ديواره ثانويه ممكن است به چهل عدد هم برسد. در هر لايه سه تركيب ديواره اوليه وجود داشته ولي مقدار سلولز ان بيشتر بوده و رشته هاي سلولزي از نظم بيشتري برخوردارند. همچنين اين رشته در هر لايه موازي همديگر بوده ولي با رشته هاي لايه مجاور خود زاويه 120 درجه مي سازند. موضوعات مرتبط: تکوین گیاهی، فیزیولوژِی گیاهی، ، برچسبها: [ جمعه 18 فروردين 1391برچسب: تکامل ديواره سلولي را در بين موجودات زنده توضيح دهيد,, ] [ 17:24 ] [ حمیدرضا قاسمی ]
مترجم : حمیدرضا قاسمی موضوعات مرتبط: تکوین گیاهی، فیزیولوژِی گیاهی، ، برچسبها: [ دو شنبه 14 فروردين 1391برچسب: آنزیم ها و عواملی دیگر که انعطاف پذیری دیواره سلولی را افزایش می دهد , ] [ 13:20 ] [ حمیدرضا قاسمی ]
خلاصه واکنش های نوری کتاب تایز: - انرژی نور جهت حرکت الکترونها از طریق گیرنده ها و دهنده ها و همچنین انتقال H+ در عرض تیلاکوئید و تولید نیروی محرکه پروتونی ((PMF استفاده می شود. - طیف جذبی: میزان انرژی جذب شده توسط یک مولکول یا ماده بعنوان تابعی از طول موج نور را نشان می دهد. - مولکول کلروفیل پس از دریافت نور قرمز و آبی از حالت بنیادی خارج و به حالت بر انگیخته منتقل می شود هر چه انرژی فتون دریافتی بیشتر باشد، بر انگیختگی شدیدتر و مدّت زمان آن کمتر خواهد بود و پایدار ترین حالت برانگیختۀ خود می رسد. از این حالت تا رسیدن به وضعیت پایه به صورت های متفاوتی انرژی تلف می شود:1- فلولؤرسانس 2- تبدیل مستقیم به گرما 3- ترافرستی یا انتقال انرژی به مولکولدیگر 4- واکنش فتوشیمیایی موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب [ دو شنبه 14 فروردين 1391برچسب: خلاصه واکنش های نوری کتاب تایز, ] [ 13:15 ] [ حمیدرضا قاسمی ]
جذب در گیاهان مقدمه: مکانیسم جذب یون ها توسط سلول های گیاهی طی سال های اخیر مورد مطالعات دقیق قرار گرفته است. علی رغم آنکه ارتباط یونی بین سلول های گیاهی با محیط اطراف از چندین نظر با سلول های جانوری اختلاف دارد، اما به طور کلی می توان از مطالب مربوط به الکتروفیزیولوژی سلول های جانوری و ویژگی های سلول های عصبی، برای سلول های گیاهی نیز استفاده نمود. از طرف دیگر کوچک بودن اندازه سلول های گیاهی، کار مطالعه آن ها را مشکل می سازد. بنابراین دانشمندان اغلب در مطالعات خود از سلول های بزرگ جلبک های مختلف که دارای هستۀ مرکزی می باشند، استفاده می نمایند و شاید به همین دلیل اطلاعات در مورد جلبک ها از گیاهان بیشتر است. منبع: http://microbiology-sh.blogfa.com/post-140.aspx موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب [ شنبه 12 فروردين 1391برچسب:جذب یون ها در گیاهان, ] [ 16:38 ] [ حمیدرضا قاسمی ]
این سوالات مربوط به 5 سال گذشته دانشگاه آزاد است موضوعات مرتبط: فیزیولوژِی گیاهی، ، برچسبها: ادامه مطلب |
|
| [ طراحی : ایران اسکین ] [ Weblog Themes By : iran skin ] | ||

 آمار
وب سایت:
آمار
وب سایت: